
| A. | NH3 | B. | H2 | C. | HCl | D. | CO2 |
分析 能用向上排气法收集的气体,不与空气中成分发生反应,且气体的密度大于空气,即气体的相对分子质量大于29,据此进行解答.
解答 解:A.NH3的密度小于空气,小于用向下排空气法收集,故A错误;
B.H2的密度小于空气,小于用向下排空气法收集,故B错误;
C.的密度大于空气,且不与空气反应,能够又能够向上排空气法收集,故C正确;
D.CO2的密度大于空气,且不与空气反应,能够又能够向上排空气法收集,故D正确;
故选CD.
点评 本题考查了常见气体的收集方法,题目难度不大,明确常见气体的性质为解答关键,注意熟练掌握常见气体的收集方法,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:实验题
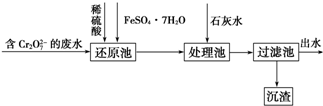
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CuO作还原剂 | B. | 铜元素化合价降低 | ||
| C. | CuO作氧化剂 | D. | 铜元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液与HNO3 | B. | Na2SO3固体与浓硫酸 | ||
| C. | 固体硫在纯氧中燃烧 | D. | 碳与热浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
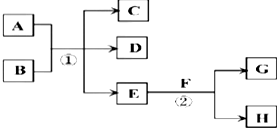
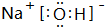 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com