
 =$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.
=$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.分析 (1)Pb2O3中+3价的Pb具有强氧化性,能氧化浓盐酸,+3价的Pb被浓盐酸还原成+2价,确定生成物PbC12、C12、H2O,再配平可得化学方程式;
(2)根据题意,确定反应物为PbO2,写出方程式,再利用方程式进行计算求解;
(3)根据氧化还原反应的本质电子得失守恒求出n(O2)、n(Cl2),即得y与x的函数关系;
(4)根据两步反应中O2和Cl2的物质的量之比为3:5,求出x的值,确定出n(pb2+):n(pb4+)的比值,再设法求解即可;
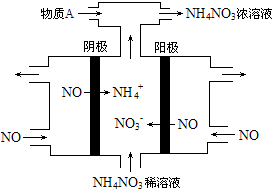
(5)电解NO制备NH4NO3,由图可知乙为阳极反应为NO-3e-+2H2O=NO3-+4H+,甲为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,根据电子守恒计算.
解答 解:(1)Pb2O3中Pb的化合价只有+3,且+3价的Pb具有氧化性,能氧化浓盐酸生成C12,本身被还原成+2价Pb,生成PbC12,根据元素守恒得反应物与生成物并根据化合价升降法配平该氧化还原反应,得出Pb2O3+6HCl(浓)═2PbCl2+Cl2↑+3H2O,
故答案为:Pb2O3+6HCl(浓)═2PbCl2+Cl2↑+3H2O;
(2)根据题意:1mol PbO2分解所得混合物中n(Pb2+)=x mol、n(Pb4+)=(1-x) mol.在反应过程中1mol PbO2中+4价的Pb具有强氧化性作氧化剂,
+4价的Pb最终全部降低为+2价,根据得失电子守恒:先加热分解生成O2,得n(O2)=$\frac{2x}{4}$a=$\frac{x}{2}$amol;
后再与足量的浓盐酸反应生成Cl2,得n(Cl2)=a×$\frac{(1-x)×2}{2}$=(1-x)a mol,
故答案为:$\frac{ax}{2}$mol;a(1-x)mol;
(3)y=n(O2)+n(Cl2)=$\frac{x}{2}$mol+(1-x)a mol=(1-$\frac{x}{2}$)amol,故答案为:y=(1-$\frac{x}{2}$)amol;
(4)若两步反应中O2和Cl2的物质的量之比为5:3,根据上述分析:n(O2)=a×$\frac{x}{2}$=mol,n(Cl2)=a(1-x)mol,即 $\frac{x}{2}$:(1-x)=5:3,解得:x=$\frac{10}{13}$,则剩余固体中含pb2+的物质的量分数为$\frac{10}{13}$,含pb4+的物质的量分数为 $\frac{3}{13}$,即n(pb2+):n(pb4+)=10:3,
由题意,PbO2不稳定逐步分解顺序:PbO2→Pb2O3→Pb3O4→PbO.因为Pb的化合价只有+2、+4,所以Pb2O3可表示为PbO•PbO2,Pb3O4可表示为2PbO•PbO2,各氧化物中n(pb2+):n(pb4+)的比值关系为:
PbO2中,n(pb2+):n(pb4+)=0:1
Pb2O3中,n(pb2+):n(pb4+)=1:1
Pb3O4中,n(pb2+):n(pb4+)=2:1
PbO中,n(pb2+):n(pb4+)=1:0,
根据剩余固体中n(pb2+):n(pb4+)=10:3,介于3:1和4:1之间,所以此时剩余固体包括Pb3O4、PbO两种物质,
设剩余固体中Pb3O4物质的量为a、PbO物质的量为b,
得n(pb2+)=2a+b,n(pb4+)=a,
则(2a+b):a=10:3
解得a:b=3:4,即Pb3O4:PbO=3:4,
故答案为:Pb3O4、PbO;3:4;
(5)电解NO制备NH4NO3,由图可知乙为阳极反应为NO-3e-+2H2O=NO3-+4H+,甲为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3;
由电子守恒可知:5NH4NO3~~~15e-~~~$\frac{15}{2}$Pb
5×80 $\frac{15}{2}$×207
1000kg xkg
解得x=$\frac{\frac{15}{2}×207×1000kg}{5×80}$=3881kg;
故答案为:NH3;根据总反应式:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$4NH4NO3+2HNO3,电解产生的HNO3多;3881.
点评 本题考查氧化还原反应知识、电解原理的应用,利用化合价升降法配平,抓住本质电子的得失守恒是解题的关键,同时结合中间值确定反应产物.题目难度中等,侧重于考查学生对基础知识的综合应用能力和分析能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锡中加入一定量的铅制成焊锡,目的使被焊接的部分更牢固,更不易被氧化 | |
| B. | 聚乙烯制成塑料薄膜,用于食品、药品包装的材料 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
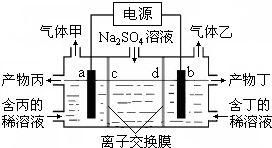 工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法中正确的是( )
工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法中正确的是( )| A. | a极与电源的负极相连 | B. | 产物丙为硫酸溶液 | ||
| C. | 离子交换膜d为阴离子交换膜 | D. | b电极反应式:4OH--4e-=O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,下层液体从分液漏斗下口放出,上层液体从上口倒出 | |
| B. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| C. | 蒸馏操作时,使用的冷凝水应该由低往高流,形成逆流 | |
| D. | 蒸发操作时,应使混合物中的水分子蒸干后,才能停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离乙醇和水的混合液体 | |
| B. | 用硝酸洗涤做过银镜反应的试管 | |
| C. | 分馏石油时,温度计的末端必须插入液面下 | |
| D. | 配制新制Cu(OH)2溶液时,在2mL10% CuSO4溶液中滴入几滴2%NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com