
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为_____________。
(2)反应AX3(g)+X2(g)===AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
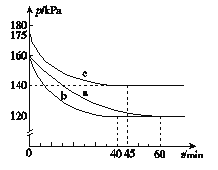
① 列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=__________。
② 图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,实验b改变的实验条件及判断依据是 。
③ 用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为__________;实验a和c的平衡转化率:αa为________,αc为________。
【答案】(1)AX3(l)+X2(g)===AX5(s) ΔH=-123.8 kJ/mol
(2)①![]() =1.7×10-4mol·L-1·min-1
=1.7×10-4mol·L-1·min-1
②bca 加入催化剂;依据是反应速率加快,但平衡状态没有改变
③α=2(1-![]() ),50%,40%
),50%,40%
【解析】试题分析:(1)因为AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃,室温时,AX3为液态,AX5为固态,生成1molAX5,放出热量123.8kJ,该反应的热化学方程为:AX3(l)+X2(g)=AX5(s);△H=-123.8kJ/mol-1,
(2)①起始时AX3和X2均为0.2mol,即no=0.4mol,总压强为160KPa,平衡时总压强为120KPa,设平衡时总物质的量为n,根据压强之比就等于物质的量之比有:120/160="n/0.4," n="0.3" mol;
AX3(g)+X2(g)===AX5(g)
初始 (mol) 0.20 0.20 0
平衡 (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=0.30解得x=0.10
v(AX5)=![]() =1.7×10-4mol·L-1·min-1
=1.7×10-4mol·L-1·min-1
②根据到a、b、c达平衡用时的多少可以比较出反应速率的大小为:b>c>a;与实验a相比,b实验到达平衡的时间变小,但平衡没有发生移动,所以为使用催化剂;c实验到达平衡时总压强变大,说明平衡逆向移动,而化学反应速率变大,考虑到该反应是放热反应。所以是升高温度所导致的;
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,根据压强之比就等于物质的量之比有:p/p0=0.4/n,n=0.4p/p0
AX3(g)+X2(g)===AX5(g)
初始 (mol)0.20 0.20 0
平衡 (mol)0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=n得x=0.40-n=0.4-0.4p/p0
α=(0.4-0.4p/p0)/0.2=2(1-p/p0)
αa为2(1-p/p0)=2(1-120/160)×100%=50%
αc为2(1-p/p0)=2(1-140/175)×100%=40%


科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中有广泛应用。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1
N2(g)+2CO2(g) △H = -746 kJ·mol-1
反应Ⅱ:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H = -1200 kJ·mol-1
N2(g)+4CO2(g) △H = -1200 kJ·mol-1
写出CO将NO2还原为NO的热化学方程式 。
(2)在一绝热恒容的容器中充入2mol CO和1mol NO2发生上述反应II,以下能说明反应达到平衡状态的是 ( )
A.容器内的总压强不在变化 B.容器内CO和NO2物质的量比不变
C.容器内气体平均密度不变 D.容器内气体温度恒定不变
(3)在密闭容器中充入5 mol CO和4 mol NO发生上述反应I,下图为平衡时NO的体积分数与温度、压强的关系。
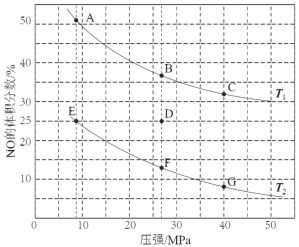
回答下列问题:
①温度:T1 T2(填“<”或“>” )。
②某温度下,在体积为2 L的密闭容器中,反应进行10分钟放出热量373 kJ,用CO的浓度变化表示的平均反应速率v(CO)= 。
③若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的 点
(4)某温度时,亚硝酸银AgNO2的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5,当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol·L-1)时,c(NO2-)= mol·L-1。
(5)如右图,在酸性条件下,电解水中CN-可转化为CO2和N2,请写出阳极的电极反应式 。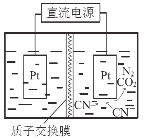
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的沸点由高到低排列的顺序是
①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH④(CH3)2CHCH2CH3⑤(CH3CH2)2CHCl
A.⑤②④①③ B.④②⑤①③ C.⑤④②①③ D.②④⑤③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是

A. x=2.24
B. 铝的物质的量为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于A1及其化合物的说法正确的是
A.AlO3不能与水反应生成Al(OH)3
B.铝是人类使用最早的金属
C.实验室常用AlCl3溶液和NaOH溶液制备Al(OH)3
D.Al制容器可以长期盛放酸性、碱性和咸的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是( )
A. H2SeO4 B. HClO4 C. H3BO3 D. H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是____________(用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的电子式为____________;
(4)E的最高价氧化物的水化物的化学式为____________;
(5)单质C在空气中燃烧的产物存在的化学键类型为 ;其反应化学方程式为 ;
(6)单质E与水反应的离子方程式为____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是( )
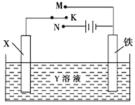
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com