
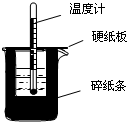
 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:分析 (1)根据中和热的测定原理分析,根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)反应放出的热量和所用酸以及碱的量的多少有关,根据中和热的概念和实质来回答;
(4)根据弱电解质电离吸热;
(5)实验要测定酸、碱的初始温度以及反应后的最高温度;
(6)不盖硬纸板,会有一部分热量散失.
解答 解:(1)由量热计的构造可知该装置缺少的仪器是环形玻璃搅拌棒,
故答案为:环形玻璃搅拌棒;
(2)大小烧杯之间填满碎纸条的作用是隔热,减少实验过程中的热量损失;
故答案为:隔热,减少实验过程中的热量损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的物质的量增多,所放出的热量偏高,但中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,中和热数值相等;
故答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小;
(5)完整地做一次这样的实验,需测定酸、碱的初始温度以及反应后的最高温度,至少需要测量3次;
故答案为:3;
(6)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小.
点评 本题主要考查了中和热的测定,可以根据所学知识进行回答,注意保温工作是实验成功的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
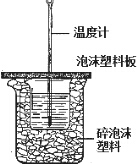 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①③④⑤ | C. | ④⑤ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于10s | B. | 等于12s | C. | 小于12s | D. | 大于13s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+、SCN-、Cl- | B. | Fe3+、Na+、S2-、Cl- | ||
| C. | K+、H+、Cl-、AlO2- | D. | Na+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | 4HNO3═4NO2↑+O2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com