
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
分析 标况下2.24LNO的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,生成0.1molNO转移电子的物质的量为:0.1mol×(5-2)=0.3mol;铜和镁都是2价金属,根据电子守恒可知金属的物质的量为:$\frac{0.3mol}{2}$=0.15mol,固体和硝酸恰好完全反应,反应生成硝酸铜、硝酸镁,根据N原子守恒,200mL该硝酸溶液中含有硝酸的物质的量为:0.15mol×2+0.1mol=0.4mol,根据c=$\frac{n}{V}$计算出硝酸的物质的量浓度;
铜与镁在空气中加热生成CuO、MgO,得到固体中含有氧元素的物质的量与金属的物质的量相等,则得到固体的质量=金属质量+氧元素质量.
解答 解:标况下2.24LNO的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,生成0.1molNO转移电子的物质的量为:0.1mol×(5-2)=0.3mol,
铜和镁都是2价金属,则金属的物质的量为:$\frac{0.3mol}{2}$=0.15mol,固体和硝酸恰好完全反应,反应生成硝酸铜、硝酸镁,根据N原子守恒,200mL该硝酸溶液中含有硝酸的物质的量为:0.15mol×2+0.1mol=0.4mol,该硝酸溶液的浓度为:$\frac{0.4mol}{0.2L}$=2mol/L,故①正确、②错误;
铜与镁在空气中加热生成CuO、MgO,得到固体中含有氧元素的物质的量与金属的物质的量相等,则得到固体的质量为:$\frac{11.2g}{2}$+16g/mol×0.15mol=8g,故③正确、④错误;
根据分析可知,正确的为①③,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握质量守恒定律、电子守恒在化学计算中的应用,试题培养了学生的分析能力及灵活应用基础知识的能力.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 由三氯化铁到氢氧化铁胶体有发生化学变化发生 | |
| B. | 氢氧化铁胶体溶液的颗粒的直径在10-9~10-7m之间 | |
| C. | 可以用丁达尔效应实验有效鉴别氯化钠溶液和氢氧化铁溶液 | |
| D. | 三氯化铁可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
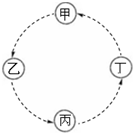 甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )
甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | Fe | FeCl3 | Fe (OH)3 | Fe2O3 |
| B | NaAlO2 | Al (OH)3 | Al2O3 | Al |
| C | Na | Na2O2 | Na2CO3 | NaCl |
| D | SiO2 | H2SiO3 | Na2SiO3 | Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g乙烯与丙稀的混合物中含有氢原子的数目为NA | |
| C. | 50mL18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
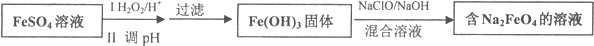
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向能使PH试纸显深蓝色的溶液中通入少量二氧化碳:OH-+CO2═HCO3- | |
| B. | 向NaClO溶液中加入浓氢溴酸:ClO-+2H++2 Br-═Cl-+Br2+H2O | |
| C. | 向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向FeBr2溶液中滴加少量HClO溶液:2Fe2++HClO═2Fe3++Cl-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
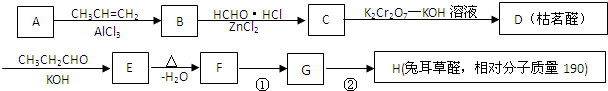
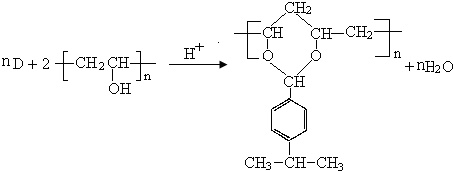
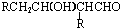 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$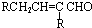
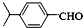 .
. .
.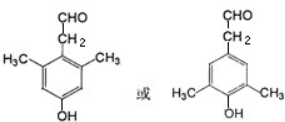 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,使煤和氢气作用,可以得到液体燃料,也可以获得洁净的燃料油 | |
| B. | (CH3)2CHCH(CH3)2的系统命名为:2,3-二甲基丁烷 | |
| C. | 硬脂酸甘油酯可以在稀硫酸中水解,也可以在NaOH溶液中发生皂化反应彻底水解 | |
| D. | 氨基酸分子中均含有氨基和羧基,加入浓的硫酸钠溶液可从溶液中析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com