
| 1 |
| 2 |
| 1 |
| 3 |
| a |
| 2 |
| 1 |
| 2 |
| a |
| 6 |
| a |
| 3 |
| a |
| 2 |
| a |
| 3 |
| a |
| 2 |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| 1 |
| 2 |
| a |
| 6 |
| a |
| 3 |
| a |
| 2 |
| a |
| 3 |
| a |
| 2 |
| ||
| 2min |
| a |
| 12 |
| 3 |
| 2 |
| 3 |
| 2 |
| a |
| 12 |
| a |
| 8 |
| a |
| 12 |
| a |
| 8 |
| a |
| b |
| a |
| b |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
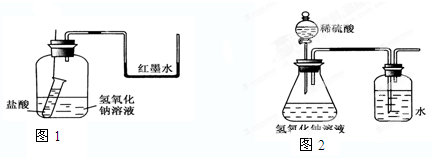
| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1mol?L-1 | 0.05mol?L-1 | 3.5 |
| 2 | 0.1mol?L-1 | 0.1mol?L-1 | x |
| 3 | 0.2mol?L-1 | 0.2mol?L-1 | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液和稀硫酸 |
| B、氯化铝溶液和氢氧化钠溶液 |
| C、四羟基合铝酸钠溶液和稀盐酸 |
| D、氯化钡溶液和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
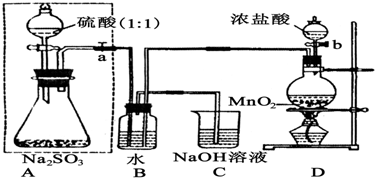
查看答案和解析>>
科目:高中化学 来源: 题型:
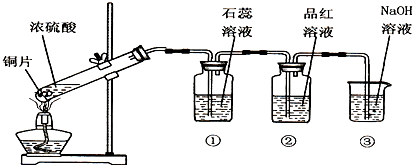
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | |
| A、乙中SO2的平衡转化率大于80% |
| B、该温度下,乙达平衡时间小于甲 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率大于乙中O2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SCl2、PCl3、CO2 |
| B、AsH3、BF3、BeCl2 |
| C、XeF2、PCl5、ClO2 |
| D、H2SO3、CO2、BrF3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com