
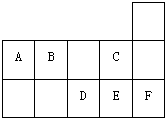
| A、A、B、D、E四种元素所形成的最高价含氧酸中D酸性最强 |
| B、形成的简单阴离子半径:C>B>D>E |
| C、D、E、F形成的单质都是双原子分子 |
| D、A与E形成的分子是一种常见有机溶剂 |


科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验 方案 |  |  |  |  |
| 实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 制备Fe(OH)2并能较长时间观察其颜色 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①②③⑤ |
| C、①②⑤ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | ||
| B、等浓度等体积的NaHSO3溶液与NaClO溶液混合后:c(Na+)+c(H+)=c(HSO3-)+c(ClO-)+2c(SO32-)+c(OH-) | ||
C、等浓度等体积的NaHCO3溶液与NaCl溶液混合后:
| ||
| D、标况下,将2.24L SO2气体通入到100ml 1mol?L-1的NaOH溶液中,完全反应后溶液呈酸性,则该溶液中:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )
向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )| A、AgNO3溶液 |
| B、NaOH溶液 |
| C、水 |
| D、FeCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁为负极,锌为正极 |
| B、铁为阳极,锌为阴极 |
| C、用可溶性铁盐作电解液 |
| D、锌元素既被氧化又被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何条件下,化学平衡常数K都是一个定值 |
| B、当改变反应物的浓度时,化学平衡常数会发生改变 |
| C、化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关 |
| D、化学平衡常数K与反应物的转化率是一一对应的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com