
| A. | ①②③④⑤ | B. | ①③⑥ | C. | ④⑤⑦ | D. | ②④⑥ |
分析 配位键的形成是一方提供孤电子对,一方提供空轨道,配位键也属于共价键,据此进行分析.
解答 解:①H3O+中,O上含有孤电子对,H+有空轨道,可以形成配位键,故①含有配位键;
②NH4+中,N上含有孤电子对,H+有空轨道,可以形成配位键,故②含有配位键;
③[Cu(H2O)4]2+中,Cu2+含有空轨道,H2O中O含有孤电子对,可以形成配位键,故③含有配位键;
④[Fe(SCN)6]3-中,Fe3+含有空轨道,SCN-中S含有孤电子对,可以形成配位键,故④含有配位键;
⑤CuCl42-中,Cu2+含有空轨道,Cl-含有孤电子对,可以形成配位键,故⑤含有配位键;
⑥CH4不含有配位键,故⑥不含有配位键;
⑦NH3不含有配位键,故⑦不含有配位键;
综上,含有配位键的有①②③④⑤,故选A.
点评 本题考查配位键的形成,属概念识记,需了解常见的配合物的形成.题目难度不大,是基础题.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 饱和氯水中:NH4+、SO32-、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- | |
| D. | c(H+)=1.0×10-13mol/L溶液中:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱溶液中:Na+.K+.AlO2-.CO32- | |
| B. | 在含大量Fe3+的溶液中:NH4+.Na+.Cl-.SCN- | |
| C. | 在c(H+)=10-13mol/L 的溶液中:NH4+.Al3+.SO42-.NO3- | |
| D. | 在pH=1的溶液中:K+.Fe2+.Cl-.NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
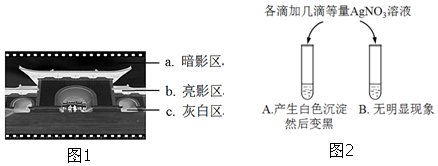
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
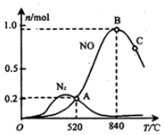 (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:| 化学键 | N≡N | O=O | NO中氮氧键 |
| 键能(kJ/mol) | 945 | 498 | 630 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| c(NH3)/mol•L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.0072 | 0.0072 |
| c(O2)/mol•L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电负性 | 第一电离能 | 熔点 | 沸点(同压) | 在水中溶解性 |
| C>H | S<P | NaF>KCl | PH3<NH3 | CH3OH>CH3SH |
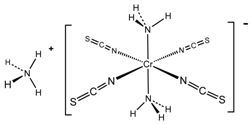
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2句 | B. | 3句 | C. | 4句 | D. | 5句 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com