
已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+5/2O2(g)—→2CO2(g)+H2O(l) ΔH=-1 300 kJ/mol
②C6H6(g)+15/2O2(g)—→6CO2(g)+3H2O(l) ΔH=-3 295 kJ/mol
下列说法正确的是( )
A.1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ
B.1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ
C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多
D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
有关钠的叙述正确的是( )
A.2.3 g钠与97.7 g水反应后溶液中溶质的质量分数等于4%
B.钠跟CuSO4溶液反应生成的蓝色沉淀上有时出现暗斑,这是析出了金属铜
C.将金属钠与水反应后的溶液中通入适量氯气后,溶液中含有两种溶质
D.钠在空气中的缓慢氧化与其在空气中点燃的产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
①CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g)
ΔH=-131.3 kJ/mol
③H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l)
ΔH=-57.3 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
⑤CO(g)+O2(g)===CO2(g) ΔH=-283 kJ/mol
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)
ΔH=-57.3 kJ/mol
⑦2H2(g)+O2(g)===2H2O(l) ΔH=-517.6 kJ/mol
(1)上述热化学方程式中,不正确的有________,不正确的理由分别是_______________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式_____________。
(3)上述反应中,表示燃烧热的热化学方程式有________________;表示中和热的热化学方程式有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多,上述盐酸溶液的浓度为( )
A.0.5 mol/L B.1.0 mol/L
C.2.0 mol/L D.3.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.化学变化过程是原子的重新组合过程
B.根据化学反应中的能量变化情况,化学反应可分为吸热反应和放热反应
C.化学反应中的能量变化多少与其反应物用量有关
D.化学反应中的能量变化都是以热能形式表现出来的
查看答案和解析>>
科目:高中化学 来源: 题型:
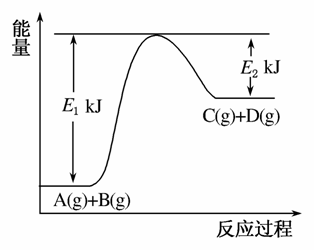
)已知某反应A(g)+B(g)C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”、“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
不能用于判断金属失电子能力强弱的是
A.同主族金属元素原子半径大小
B.1 mol金属单质在反应中失去电子的多少
C.水溶液中金属间发生的置换反应
D.金属元素最高价氧化物对应水化物的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153ºC)与氢氧化铁制得。其结构如右图。
(1)柠檬酸的晶体类型为 。
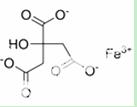 (2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(3)柠檬酸铁所含非金属元素,电负性从小到大的顺序为
(填元素符号)。
(4)柠檬酸铁中,碳原子的杂化轨道类型为 。
(5)I2(Fe) I3(Fe)(填“>”或“<”)。
(6)柠檬酸铁溶液中不存在的微粒间作用力为 (填序号)。
A.离子键 B.极性键 C.非极性键
D.金属键 E.氢键 F.范德华力
(7)H3O+中H-O-H键角比H2O中H-O-H键角大,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知:
A(s)+B(g)====C(g)+D(g) ΔH=+131.4 kJ·mol-1,
某同 学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
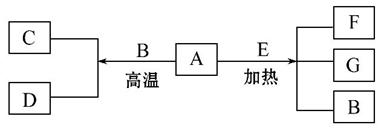
(1) 写出A元素的名称________。
写出A元素的名称________。
(2)另外知:A(s)+O2(g)====G(g) ΔH=-393.6 kJ·mol-1
C(g)+ O2(g)====G(g) ΔH=-283 kJ·mol-1
O2(g)====G(g) ΔH=-283 kJ·mol-1
D(g)+ O2(g)====B(g) ΔH=-242 kJ·mol-1
O2(g)====B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?___________,理由是___[.Com ]
]
____________________________________________________。
(3)写出A+O2→C的热化学方程式:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com