
| A. | 1.8 g 重水(D2O)中含有的中子数为NA | |
| B. | 常温常压下,22.4 L O2 含有的分子数为NA | |
| C. | 1 L 1 mol/L FeCl3溶液中含有Fe3+的数目为NA | |
| D. | 0.1 mol CO2分子中含有的共用电子对的数目是0.4 NA |
分析 A、重水的摩尔质量为20g/mol;
B、常温常压下气体摩尔体积大于22.4L/mol;
C、铁离子为弱碱阳离子,在溶液中会水解;
D、1个二氧化碳分子中含4对共用电子对.
解答 解:A、重水的摩尔质量为20g/mol,故1.8g重水的物质的量为0.09mol,故含0.9NA个中子,故A错误;
B、常温常压下气体摩尔体积大于22.4L/mol,故22.4L氧气的物质的量小于1mol,则分子个数小于NA个,故B错误;
C、铁离子为弱碱阳离子,在溶液中会水解,故溶液中的铁离子的个数小于NA个,故C错误;
D、1个二氧化碳分子中含4对共用电子对,故0.1mol二氧化碳中含0.4NA对共用电子对,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | B. | C(CH3)3(OH)的名称:1,1-二甲基乙醇 | ||
| C. | Na2O2的电子式: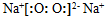 | D. | Mg2+的电子排布式:1S22S22P6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含有Cl2和H2O两种物质 | |
| B. | 新制氯水可以使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,逸出的气体只有氯气 | |
| D. | 氯水放置数天后酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol/L | B. | 0.3mol/L | C. | 0.015mol | D. | 0.25 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| C. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| D. | 为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
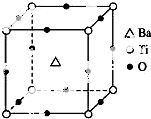 如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )
如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )| A. | 8 BaTi8O12 | B. | 8 BaTi4O9 | C. | 6 BaTiO3 | D. | 3 BaTi2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
 .元素⑩名称为溴.
.元素⑩名称为溴.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com