
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 四种溶液的pH的大小顺序:①>④>③>② | |
| B. | 将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3•H2O) | |
| C. | 向溶液①、②中分别滴加25mL 0.1mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | 将溶液③、④等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?H+(aq)+F-(aq)△H=+10.4 KJ•mol-1 | |
| B. | 当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol?L-1 | |
| C. | 当V=20时,溶液中:c(Na+)>c(F-)>c(OH-)>c(H+) | |
| D. | 当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )| A. | 该物质既可看作醇类,也可看作酚类 | |
| B. | 1mol该物质可与4molBr2反应 | |
| C. | 1mol该物质可与7molNaOH反应 | |
| D. | 1mol该物质可与7molNa反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
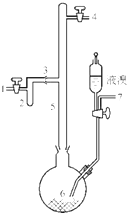 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| n(A) | 2.00 | 1.90 | 1.82 | 1.76 | 1.64 | 1.54 | 1.50 | 1.50 | 1.50 |
| n(B) | 1.00 | 0.95 | 0.91 | 0.88 | 0.82 | 0.77 | 0.75 | 0.75 | 0.75 |
| n(C) | 0 | 0.10 | 0.18 | 0.24 | 0.36 | 0.46 | 0.50 | 0.50 | 0.50 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离的c( H+)=1×l0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42-、Cl- | |
| C. | $\frac{{K}_{W}}{c(O{H}^{-})}$=l×l0-13mol/L的溶液中:Ba2+、ClO-、Cl-、NO3- | |
| D. | 能与铝反应放出H2的溶液中:Fe2+、K+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com