
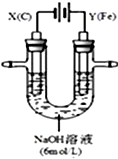
 某课外小组分别用如图所示装置对电解原理进行实验探究.
某课外小组分别用如图所示装置对电解原理进行实验探究.分析 用Fe作阳极、石墨作阴极电解NaOH溶液,实验过程中,两极均有气体产生,X电极上水失电子生成氢气,Y电极上氢氧根离子失电子生成氧气,同时Y极区溶液逐渐变成紫红色,停止实验,铁电极明显变细,电解液仍然澄清,说明Fe在阳极上失电子而溶解,且有高铁酸根离子生成;
(1)电解过程中,X电极上水得电子生成氢气同时有OH-生成;
(2)电解过程中,Y电极上氢氧根离子失电子生成氧气和水;
(3)根据转移电子守恒计算溶解Fe的质量;
(4)该电池中Fe元素化合价由+6价变为+3价、Zn由0价变为+2价,所以锌作负极,正极上高铁酸根离子得电子和水反应生成氧化铁和氢氧根离子.
解答 解:用Fe作阳极、石墨作阴极电解NaOH溶液,实验过程中,两极均有气体产生,X电极上水失电子生成氢气,Y电极上氢氧根离子失电子生成氧气,同时Y极区溶液逐渐变成紫红色,停止实验,铁电极明显变细,电解液仍然澄清,说明Fe在阳极上失电子而溶解,且有高铁酸根离子生成;
(1)电解过程中,X电极上水得电子生成氢气同时有OH-生成,导致溶液碱性增大,故答案为:增大;
(2)电解过程中,Y电极上氢氧根离子失电子生成氧气和水,电极反应式为4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
(3)X电极上得到氢气,n(H2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,Y电极上得到n(O2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,根据转移电子守恒计算溶解Fe的质量=$\frac{0.05mol×2-0.01mol×4}{6}$×56g/mol=0.56g,
故答案为:0.56;
(4)该电池中Fe元素化合价由+6价变为+3价、Zn由0价变为+2价,所以锌作负极,正极上高铁酸根离子得电子和水反应生成氧化铁和氢氧根离子,电极反应式为2FeO42-+6e-+5H2O═Fe2O3+10OH-,故答案为:2FeO42-+6e-+5H2O═Fe2O3+10OH-.
点评 本题考查电解原理及有关计算,为高频考点,侧重考查学生分析计算能力,注意活泼金属作阳极上发生的反应,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:解答题
 CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.
CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化铝溶液中加入过量氨水:氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氨气通入醋酸溶液中:NH3+CH3COOH═CH3COO+NH4+ | |
| C. | 氯化铁溶液中加入铁粉:Fe+2FeCl3═2Fe+3Cl- | |
| D. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
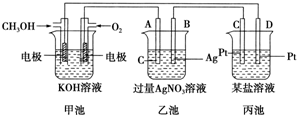
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbCO3 | B. | SnCO3•Sn(OH)2 | C. | 2PbCO3•Pb(OH)2 | D. | (CH3COO)2Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能将E从HE的溶液中置换出来 | |
| B. | 气态氢化物的稳定性:D>A>B | |
| C. | 离子半径由大到小的顺序是A>J>H | |
| D. | 最高价氧化物的水化物的碱性:H>I>J |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个原子或多个原子之间的相互作用叫做化学键 | |
| B. | 阴、阳离子通过静电引力而形成的化学键叫做离子键 | |
| C. | 只有金属原子和非金属原子化合时才能形成离子键 | |
| D. | 大多数的盐、碱和金属氧化物中含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子的双键中有一个键较易断裂 | |
| B. | 乙烯分子里所有原子都在同一平面上,且碳氢键之间的键角为120° | |
| C. | 乙烯的化学性质比乙烷活泼 | |
| D. | 乙烯和环丙烷(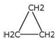 )的分子组成符合通式CnH2n,因此它们属于同系物 )的分子组成符合通式CnH2n,因此它们属于同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com