
| A. | 该条件下32g S(s)完全燃烧放出的热量为297.23kJ | |
| B. | 反应S(g)+O2(g)═SO2(g)的△H大于-297.3kJ•mol-1 | |
| C. | 反应S(g)+O2(g)═SO2(g)的△H小于-297.3kJ•mol-1 | |
| D. | 形成1 mol SO2(g)中的化学键所释放的总能量大于断裂1 mol S(s)和1mol O2(g)中的化学键所吸收 |
分析 由S(s)+O2(g)═SO2(g)△H=-297.23kJ/mol,可知该反应为放热反应,S(s)=S(g)为吸热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,以此来解答.
解答 解:A.32g固体S的物质的量为1mol,由S(s)+O2(g)═SO2(g)△H=-297.23kJ/mol,所以1molS(s ) 和1molO2(g)反应生成1molSO2(g)时放出297.23kJ的热量,故A正确;
B.由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,故B错误;
C.由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,故C正确;
D.该反应为放热反应,则形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量,故D正确;
故选B.
点评 本题考查了热化学方程式的书写方法及表示的意义,明确燃烧的概念及反应热与键能、盖斯定律的关系即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
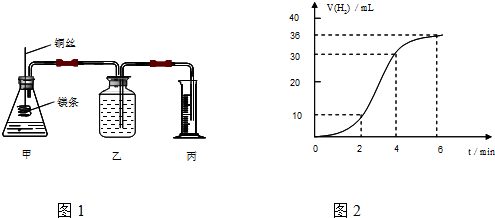
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质中含有三种金属元素 | |
| B. | 该物质的一个分子中含有10个原子 | |
| C. | 该物质由四种原子直接构成 | |
| D. | 该物质中钠元素与氧元素质量比为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
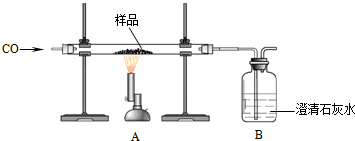
| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.50g | 反应前55.56g | 反应前281.00g |
| 反应后55.08g | 反应后281.25g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 |
| 加3%Na2S2O3溶液 | 5mL | 5mL | 5mL |
| 1:5的硫酸 | 25滴 | 15滴 | 25滴 |
| 温度/℃ | 室温 | 室温+10 | 室温+20 |
| 出现浑浊的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 加入新制的生石灰,再加热蒸馏,可以除去乙醇中的少量水 | |
| D. | Mg(OH)2中混有少量Al(OH)3,加入足量烧碱溶液,充分反应,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2被还原 | B. | Ag是氧化剂 | C. | Ag得到电子 | D. | O2发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com