
| A. | 1mol氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4L | |
| B. | 1mol臭氧和1.5mol氧气含有相同的氧原子数 | |
| C. | 等体积、浓度均为1mol•L-1的磷酸和盐酸,电离出的氢离子数之比为3:1 | |
| D. | 等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3 |
分析 A、氧原子的物质的量是氧气的2倍,根据N=nNA计算氧原子数目,根据V=nVm计算氧气体积.
B、臭氧中氧原子的物质的量是臭氧的3倍,氧气中氧原子是氧气的2倍,氧原子物质的量相等氧原子数目相等.
C、磷酸属于弱电解质,不能完全电离.
D、干冰分子式是CO2,葡萄糖分子式是C6H12O6,等物质的量的干冰和葡萄糖中所含碳原子数之比等于分子式碳原子数目之比、氧原子数之比等于分子式中氧原子数目之比.
解答 解:A、1mol O2含有氧原子数目为1mol×2×6.02×1023mol-1=1.204×1024,在标准状况下占有体积1mol×22.4L/mol=22.4L,故A正确;
B、1mol O3含有氧原子物质的量为3mol,1.5mol O2含有氧原子物质的量为1.5mol×2=3mol,二者含有氧原子物质的量相等,所以含有氧原子数目相同,故B正确;
C、磷酸属于弱电解质,不能完全电离,所以等体积、浓度均为1mol/L的磷酸和盐酸,电离出来的氢离子数之比小于3:1,故C错误;
D、干冰分子式是CO2,葡萄糖分子式是C6H12O6,等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,所含氧原子数之比为2:6=1:3,故D正确.
故选:C.
点评 本题考查常用化学计量计算、弱电解质电离等,难度不大,注意基础知识的掌握理解.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 德国化学家维勒首次实现了人工合成有机物 | |
| B. | 原子吸收光谱常用来确定物质中含有非金属元素 | |
| C. | 所有金属元素都可以用焰色反应来确定其存在 | |
| D. | SO2能溶于水,水溶液能导电,所以SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盛有10mL水的量筒中倒入浓硫酸即得稀硫酸 | |
| B. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 用托盘天平称量药品时,左盘放药品,右盘放砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


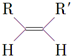 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO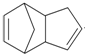 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$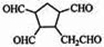 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B能发生消去、氧化、取代、缩聚等反应 | |
| C. | 1molM与足量烧碱溶液反应,可消耗2nmolNaOH | |
| D. | A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
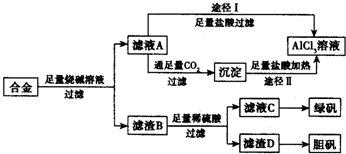 工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:
工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com