
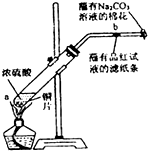
 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.反应一段时间后,停止加热.回答下列问题:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.反应一段时间后,停止加热.回答下列问题:
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、蔗糖和麦芽糖、淀粉和纤维素分别属于同分异构体 |
| B、煤经干馏、气化和液化三个物理变化过,可变为清洁能源 |
| C、可通过丁达尔效应来鉴别蛋白质溶液和葡萄糖溶液 |
| D、加热杀流感H7N9病毒是因为其蛋白质受热发生盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、处理过程中银器一直保持恒重 |
| B、黑色褪去的原因是黑色Ag2S转化为白色AgCl |
| C、该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 |
| D、银器为正极,Ag2S被还原生成单质银 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 44.6 | 略 |
| S2Cl2 | -77 | 137 | S2Cl2、遇水生成HCl、SO2、S且温度过高容易分解(300度以上完全分解) |
| SCl2 | -121 | 59.6(分解) |
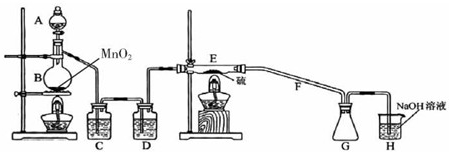
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
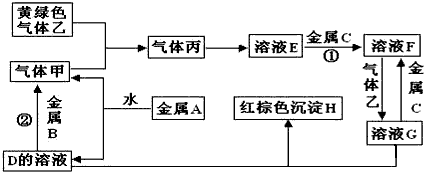
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com