
【题目】反应8NH3+3Cl2→N2+6NH4Cl的相关描述中正确的是
A.N2的电子式是 ![]()
B.反应物和生成物的化学键类型相同
C.每生成11.2 L N2,转移电子数为3 NA
D.还原剂与还原产物的物质的量之比是1∶3
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
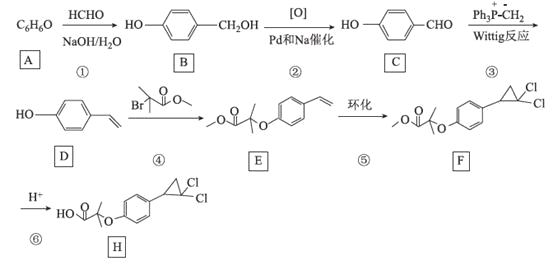
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据:
苯 | 溴 | 溴苯 | |
密度/g·cm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
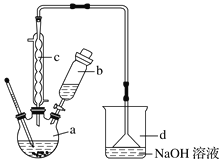
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体,继续滴加液溴滴完。铁屑的作用是___________;a中发生的化学反应方程式______________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A.重结晶B.过滤C.蒸馏D.萃取
(4)在该实验中,a的容积最适合的是_______(填入正确选项前的字母)。
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别是__、__(填标号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)r(Li+)__r(H-),原因是___。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是__。中心原子的杂化形式为___。LiAlH4中,存在__(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图a的BornHaber循环计算得到。
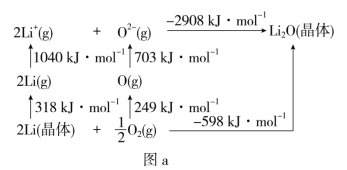
可知,Li原子的第一电离能为__kJ·mol-1,O=O键键能为__kJ·mol-1,Li2O晶格能为__kJ·mol-1。
(5)Li2O具有反萤石结构,晶胞如图b所示,已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为___g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
A. 向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
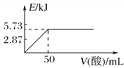
B. H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 氢气的标准燃烧热为241.8 kJ·mol-1
D. 若反应②中水为液态,则同样条件下的反应热:ΔH>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是( )

A. HX的电离常数Ka的数量级为10-10
B. P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定过程中可选用的指示剂有甲基橙和酚酞
D. A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是重要的半导体材料,是构成现代电子工业的基础。硅及其化合物在工业中应用广泛,在工业上,高纯硅可以通过下列流程制取:
![]()
完成下列填空:
(1)氯原子核外有_______种不同能量的电子,硅原子的核外电子排布式是_______________。
(2)碳与硅属于同主族元素,熔沸点SiO2 ________CO2 (填写“>”、“<”或“=”),其原因是_____________________________________________________。
(3)流程中由SiO2制粗硅的反应不能说明碳的非金属性强于硅,原因是_________________;请写出一个能说明碳的非金属性强于硅的化学方程式______________________________。
(4)SiHCl3(g) + H2(g)![]() Si(s) + 3HCl(g) -Q (Q>0)
Si(s) + 3HCl(g) -Q (Q>0)
①上述反应的平衡常数表达式K=_____________;能使K增大的措施是_______________。
②一定条件下,在固定容积的密闭容器中,能表示上述反应达到平衡状态的是________(选填编号)。
a.3v逆(SiHCl3)=v正(HCl) b.混合气体的压强不变
c.K保持不变 d.c(SiHCl3)∶c(H2)∶c(HCl)=1∶1∶3
③一定温度下,在2L密闭容器中进行上述反应,5min后达到平衡,此过程中固体质量增加0.28g,此时HCl的化学反应速率为 ________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为综合利用高浓度磷复肥工业的副产品磷石膏![]() 主要成分为
主要成分为![]() ,进行的研究如下:
,进行的研究如下:
![]() 一定条件下,
一定条件下,![]() 的脱水反应相关的热化学方程式如下:
的脱水反应相关的热化学方程式如下:
![]()
![]()
![]()
![]()
![]()
![]()
则该条件下反应![]() 的
的![]() ________
________![]() 。
。
![]() 作还原剂与磷石膏的反应为
作还原剂与磷石膏的反应为![]()
![]() 。向盛有
。向盛有![]() 的
的![]() 真空恒容密闭容器中充入
真空恒容密闭容器中充入![]() ,反应体系起始总压强为
,反应体系起始总压强为![]() ,在
,在![]() 下,固体物质的物质的量随时间变化的关系如图1所示。
下,固体物质的物质的量随时间变化的关系如图1所示。
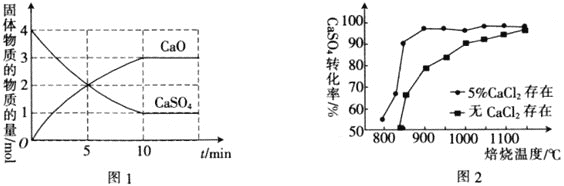
![]() 内,
内,![]() ________。
________。
![]() 达到平衡时,CO的转化率为________。
达到平衡时,CO的转化率为________。
![]() 该反应的压强平衡常数
该反应的压强平衡常数![]() ________
________![]() 用含a的代数式表示;用平衡分压代替平衡浓度计算,分压
用含a的代数式表示;用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 以高硫煤为还原剂焙烧磷石膏,可将
以高硫煤为还原剂焙烧磷石膏,可将![]() 还原,得到的
还原,得到的![]() 可用于工业生产硫酸。图2为熔烧
可用于工业生产硫酸。图2为熔烧![]() 小时内
小时内![]() 对硫酸钙转化率的影响图像,焙烧温度达到
对硫酸钙转化率的影响图像,焙烧温度达到![]() 之前,使用
之前,使用![]() 可以________
可以________![]() 填“提高”“降低”或“不影响”
填“提高”“降低”或“不影响”![]() 的转化率。
的转化率。
![]() 利用反应
利用反应![]() 可将磷石膏转化为硫酸铵。
可将磷石膏转化为硫酸铵。
![]() 已知:氨水
已知:氨水![]() ,碳酸
,碳酸![]() ,
,![]() 。则
。则![]() 溶液显________
溶液显________![]() 填“酸性”“碱性”或“中性”
填“酸性”“碱性”或“中性”![]() 。
。
![]() 的
的![]() 溶液显酸性的原因是________
溶液显酸性的原因是________![]() 用离子方程式表示
用离子方程式表示![]() ,溶液中
,溶液中![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相应实验,能达到实验目的的是
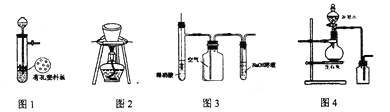
A. 图1所示装置用于Cu和浓硫酸反应制取少量的SO2气体
B. 图2装置用于除去碳酸氢钠固体中的少量碳酸钠
C. 图3装置用于制备并收集NO气体
D. 图4所示装置制取并收集氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com