

| ||
| 催化剂 |
| ||
| 催化剂 |


科目:高中化学 来源: 题型:
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO3-、NH4+ | NaHSO4溶液 | 3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| B | Ca2+、HCO3-、Cl- | 少量NaOH 溶液 | Ca2++2HCO3-+2OH-═2H2O+CaCO3↓+CO32- |
| C | K+、AlO2-、HCO3- | 通入少量CO2 | 2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- |
| D | NH4+、Al3+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH═BaSO4↓+2NH3?H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 电解池 | 燃料电池 |
| A | 阴极:Mg2++2e-═Mg | 负极:CH3CH2OH-12e-+16OH-═2CO32-+11H20 |
| B | 阳极:还原反应 | 正极:氧化反应 |
| C | 每生成4mol镁 | 消耗46g乙醇 |
| D | 化学能转化为电能 | 电能转化为化学能 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 [化学--选修物质结构与性质]
[化学--选修物质结构与性质]
| ||
| ||
 ,由短周期元素构成的与SO
,由短周期元素构成的与SO2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| pH | 3.7 | 9.8 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| KOH |
| △ |
| -H2O |
 )在食品、化妆品等工业中用作香料添加剂.其合成流程为(部分产物及反应条件已略去,键线式参见本试卷第12题):
)在食品、化妆品等工业中用作香料添加剂.其合成流程为(部分产物及反应条件已略去,键线式参见本试卷第12题):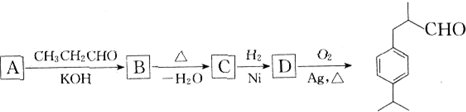
| 浓硫酸 |
| 170℃ |
| 高温高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硫酸钠跟硫酸反应:SO32-+2H+═SO2↑+H2O |
| B、铁跟三氯化铁溶液反应:Fe+Fe3+=2Fe2+ |
| C、硫化亚铁跟盐酸反应:2H++S2-═H2S↑ |
| D、碳酸钙和盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com