
| A. | 称取1.44g硫酸铜,配成100mL溶液 | B. | 称取2.25g胆矾,加入100mL水 | ||
| C. | 称取1.6g硫酸,加入100mL水 | D. | 称取2.5g胆矾,配成100mL溶液 |
分析 实验室需用90mL0.1mol/L的硫酸铜溶液,用100mL的容量瓶配制,则配制出100mL0.1mol/L的溶液.
若用硫酸铜固体来配制,所需的硫酸铜的物质的量n=CV=0.1mol/L×0.1L=0.01mol,所需的质量m=nM=0.01mol×160g/mol=1.6g;
若用胆矾来配制,由于1mol胆矾能提供1mol硫酸铜,故需要胆矾的物质的量也为0.01mol,质量m=nM=0.01mol×250g/mol=2.5g.
据此分析解答.
解答 解:实验室需用90mL0.1mol/L的硫酸铜溶液,用100mL的容量瓶配制,则配制出100mL0.1mol/L的溶液.
若用硫酸铜固体来配制,所需的硫酸铜的物质的量n=CV=0.1mol/L×0.1L=0.01mol,所需的质量m=nM=0.01mol×160g/mol=1.6g;
若用胆矾来配制,由于1mol胆矾能提供1mol硫酸铜,故需要胆矾的物质的量也为0.01mol,质量m=nM=0.01mol×250g/mol=2.5g.
A、所称取的硫酸铜的质量错误,应为1.6g,故A错误;
B、所称取的胆矾的质量错误,应称取2.5g,且不能加入100mL水,这样最后溶液体积将大于100mL,故B错误;
C、不能将1.6g硫酸铜加入100mL水中,这样最后溶液体积将大于100mL,故C错误;
D、若用胆矾来配制,所需胆矾的质量为2.5g,且溶于水配制成100mL溶液,即最后溶液的体积为100mL,符合题目要求,故D正确.
故选D.
点评 本题考查了一定物质的量浓度溶液的配制,应注意由于实验室无90mL容量瓶,应用100mL容量瓶来配制,由此来计算所需的硫酸铜和胆矾的质量.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 把100mL3mol•L-1 的H2SO4跟100 mLH2O 混合,硫酸的物质的量浓度改变为1.5 mol•L-1 | |
| B. | 把200mL3mol•L-1 的BaCl2 溶液跟100mL3mol•L-1 的KCl 溶液混合后,溶液中的c(Cl-)仍然是3 mol•L-1 | |
| C. | 把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的质量分数是10% | |
| D. | 把100mL20%的NaOH 溶液跟100mLH2O混合后,NaOH溶液的质量分数是10% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
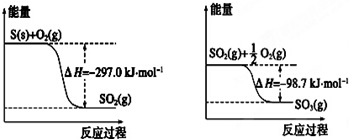
| A. | 1 mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0 kJ | |
| B. | 在相同条件下,SO2 (g)比SO3 (g)稳定 | |
| C. | S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+$\frac{3}{2}$O2(g)?SO3(g)△H=+395.7 kJ•mol-1 | |
| D. | 一定条件下1 mol SO2(g)和$\frac{1}{2}$ mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH═Na++OH- | B. | H2SO4═H2++SO42- | C. | KClO3═ClO3-+K+ | D. | NaCl═Na++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用作“钡餐”的物质主要成分是硫酸钡 | |
| B. | 采用催化设施,将汽车尾气中CO和NO转化为无害气体 | |
| C. | SO2具有还原性,可用于漂白纸浆 | |
| D. | 常温下,可以用铁制容器来盛装冷的浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)一定温度下,向1L 0.l mol•L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中$\frac{c(C{H}_{3}CO{O}^{-}).c(H{+}^)}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”).
(1)一定温度下,向1L 0.l mol•L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中$\frac{c(C{H}_{3}CO{O}^{-}).c(H{+}^)}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | |
| B. | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2(FeS2中S为-1) | |
| C. | HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2(HgS中S为-2价) | |
| D. | 2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com