
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程图如图:
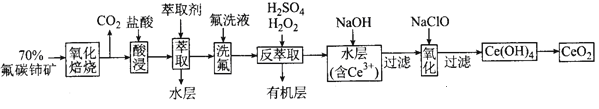
已知:①Ce4+既能与F-结合成[CeFX](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式_____,为避免上述污染,请提出一种解决方案:_____。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为_____。
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为_____。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+,H2O2在该反应中作_____(填“催化剂”、“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子物质的量为_____。
(5)“氧化”步骤的化学方程式为_____。
(6)取上述流程得到的CeO2产品0.50g,加硫酸溶解后,用0.10mol/L FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不参加反应),消耗25.00mL标准溶液。该产品中CeO2的质量分数为_____(Ce的相对原子质量为140)。
【答案】增大固体与空气的接触面积,增大反应速率,提高原料利用率2CeO2+2Cl-+8H+=2Ce3++Cl2↑+4H2O将HCl(盐酸)改用H2SO4酸浸分液漏斗还原剂2mol2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl86%
【解析】
氟碳铈矿(主要含CeFCO3),“氧化焙烧”的目的是将+3价铈氧化成+4价,Ce4+能与F-结合成[CeFx](4-x)+,以便后续的提取,加稀硫酸,与硫酸根结合成[CeSO4]2+,加萃取剂,氟洗液,硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能,加“反萃取”、加H2O2,又将Ce4+还原为Ce3+,发生反应2Ce4++H2O2=2Ce3++O2↑+2H+,加入碱后Ce3+转化为沉淀,加入次氯酸钠将Ce从+3氧化为+4,得到产品,据此解答。
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是增大固体与空气的接触面积,增大反应速率,提高原料利用率;
(2)“酸浸”中会产生大量黄绿色气体应为氯气,CeO2与盐酸发生氧化还原反应生成Ce3+和氯气,反应的离子方程式为2CeO2+2Cl-+8H+=2Ce3++Cl2↑+4H2O,可以用硫酸代替盐酸而避免产生氯气污染;
(3)实验室中萃取时用到的主要玻璃仪器名称为分液漏斗;
(4)“反萃取”加H2O2的作用是将Ce4+离子重新还原为Ce3+,反应的离子方程式为2Ce4++H2O2=2Ce3++O2↑+2H+,H2O2在该反应中作还原剂,每有1mol H2O2参加反应,转移电子的物质的量为2mol;
(5)“氧化”步骤中用次氯酸钠将Ce3+氧化成Ce4+,反应的离子方程式为2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;
(6)FeSO4的物质的量为0.1000molL-1×0.025L=0.0025mol,根据电子得失守恒可得关系式CeO2~FeSO4,所以CeO2的质量为0.0025×172g=0.4300g,产品中CeO2的质量分数为
0.4300g/0.500g×100%=86%。


科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
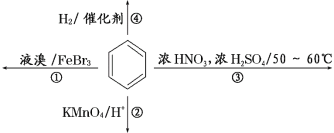
A. 反应①常温下不能进行
B. 反应②不发生,但是仍有分层现象,紫色层在上层
C. 反应③为取代反应,加热方式为酒精灯直接加热
D. 反应④能发生,生成的产物其二氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A. 单位时间内消耗1molA的同时生成2molC
B. 单位时间内消耗nmolA的同时生成2nmolB
C. A、B、C的物质的量之比为1:2:3
D. A、B、C的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)基态氮原子的价电子排布图是______________。
(2)B、N、O三种元素第一电离能从大到小的顺序是__________。
(3)NaNO2中氮原子的杂化方式是____________,阴离子的立体构型是__________。
(4)NF3的键角____________NH3的键角(填“<”“>”或“=”),原因是____________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有_______mol配位键。
(6)安全气囊的设计原理为6NaN3+Fe2O3![]() 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①该反应中元素的电负性由大到小的顺序是____________;
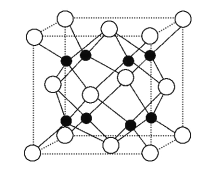
②Na2O的晶胞结构如图所示,晶胞边长为566 pm,晶胞中氧离子的配位数为____________,Na2O晶体的密度为________g·cm-3(只要求列算式,不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表示正确的是 ( )
A. 往FeI2溶液中通入过量氯气:Cl2+2Fe2+===2Cl-+2Fe3+
B. 将明矾溶于水中生成胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C. 大理石溶于醋酸中:CaCO3+2H+===Ca2++H2O+CO2↑
D. 铜与稀硝酸反应:3Cu+4H++2NO3-===3Cu2++2NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是依据一定的分类标准,对某些物质与水反应情况进行分类的图示。
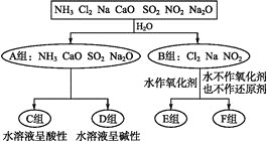
请根据你所学的知识,按要求填空:
(1)上述第一级分类标准(分成A,B组的依据)是____。
(2)F组中物质除了Cl2外还有____(填化学式)。
(3)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属的物质类型为____(用序号填空)。
①金属氧化物 ②碱性氧化物 ③碱 ④碱性干燥剂
CaO可作干燥剂的理由是____________(用化学方程式表示)。
(4)D组中NH3的水溶液呈弱碱性,用电离方程式表示其呈弱碱性的原因:________。
(5)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,可能含有以下离子中的几种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现取三份各100mL溶液进行如下实验: 第一份加入
现取三份各100mL溶液进行如下实验: 第一份加入![]() 溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到
溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到![]() 气体;第三份加足量
气体;第三份加足量![]() 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 。你认为以下结论正确的是
。你认为以下结论正确的是
A. 该混合液中一定含有:![]() 、
、![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() ,且
,且![]()
B. 该混合液中一定含有:![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() 、
、![]()
C. 该混合液中一定含有:![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() 、
、![]() 、
、![]()
D. 该混合液中一定含有:![]() 、
、![]() ,可能含
,可能含![]() 、
、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想已成为现实。某化学兴趣小组在实验室中模拟上述过程(反应缓慢不发生爆炸),其设计的模拟装置如下:
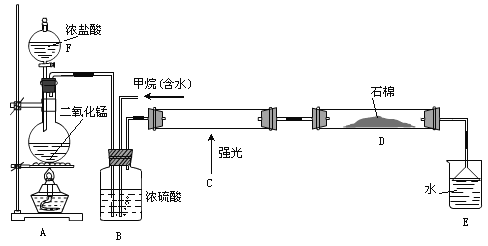
根据要求填空:
(1)仪器F的名称______________;A中反应的离子反应方程式___________________。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体③______________________。
(3)为了除多余的氯气,D装置中的石棉网均匀附着KI粉末,你认为能否换成碱石灰______(填“能”或“不能”)。
(4)E装置的作用________。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)E装置中除了盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com