
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用___________________。
(2)脱色槽中应加入的物质X是_______________;设备A的作用是______________;设备B的名称为________________;设备C的作用是____________________。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是_____________。反应的化学方程式为_________________。
| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
(1)盐酸
(2)活性炭 蒸发浓缩 过滤器 脱水干燥
(3)C Ca(OH)2+H2S=CaS+2H2O
(4)对母液回收利用,降低废弃物排放量,提高经济效益
(5)阴极2H++2e-=H2↑。阳极 2Cl--2e-=Cl2↑。
解析试题分析:(1)因为用电石浆制取无水氯化钙,所以在反应器中加入的酸应选用非氧化性的盐酸。(2)在脱色槽中应加入的物质X是由吸附作用的活性炭。活性炭因为有吸附作用而使物质脱色。过滤器把沉淀过滤除去,得到的滤液在设备A中蒸发浓缩得到氯化钙晶体,再把氯化钙晶体过滤出来,在设备C中的HCl的气氛中脱水干燥得到无水氯化钙。(3)废气H2S是大气污染物。要将其通入吸收池,由于该气体的水溶液呈碱性,所以下列物质中最适合作为吸收剂的是石灰乳。选项为C.反应的化学方程式为Ca(OH)2+ H2S =CaS+2H2O (4)将设备B中产生的母液重新引入反应器的目的是对母液回收利用,降低废弃物排放量,提高经济效益(5)氯碱工业的总方程式为:2NaCl+2H2O 2NaOH+ H2↑+ Cl2↑。其中的电极方程式为:阴极2H++2e-=H2↑。阳极 2Cl--2e-=Cl2↑。
2NaOH+ H2↑+ Cl2↑。其中的电极方程式为:阴极2H++2e-=H2↑。阳极 2Cl--2e-=Cl2↑。
考点:考查用氯碱工业中的一种废弃物电石浆来生成无水氯化钙的反应原理。主要包括试剂的选择、仪器的名称及作用、化学反应方程式及电极反应式的书写及物质的循环利用的知识。


科目:高中化学 来源: 题型:填空题
海洋是一个巨大的化学资源宝库,下图是海水加工的示意图:
(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中试剂A的化学式 , 溶液中发生反应的化学方程式为 。
溶液中发生反应的化学方程式为 。
(3)制备金属镁是通过电解熔融的 ,而不用MgO,其原因是
,而不用MgO,其原因是
。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2。海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从海水制备金属镁的流程如图所示:
(1)为了节约成本,充分利用海滩资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式:__________;__________。
(2)向石灰乳中加入MgCl 溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
(3)从熔点与硬度方面来看,镁合金与镁相比较,其特点有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
精细化学品具有品种多、批量少、产值高的特点。
(1)表面活性剂在工农业生产和日常生活中广泛应用,其优点是______________,能显著降低水与空气或其他物质的________,提高工业生产________,提高产品的________,故表面活性剂被称为_________________。
(2)在泡沫灭火器中添加表面活性剂可以提高灭火效果的原因是什么?
(3)精细化学品具有特定的功能,特殊的用途,如有些洗衣粉适用于洗衣机,加酶洗衣粉不能用于洗涤____________,医药和农药都有严格的________、__________等。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是 、 。反应设备不能用玻璃材质的原因是 (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PCl5极易水解,其产物为两种酸,写出PCl5水解的化学方程式: 。
(3)第④步分离采用的方法是 ;第⑤步分离尾气中HF、HCl采用的方法是 。
(4)LiPF6产品中通常混有少量LiF。取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为 mol(用含有w、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。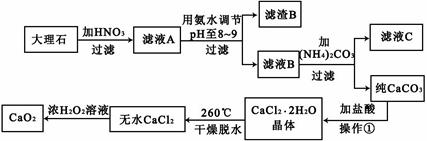
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
磷酸盐骨水泥具有良好的生物相容性和生物活性。医药工业利用共沉淀原理,通过控制Ca/P物质的量比n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和15]流程如下:
(注:Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4均难溶于水;Ca(H2 PO4)2溶液pH<7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:
(1)流程中强调“滴加速度100mL/45min的作用是 。流程中调pH选氨水,不选生石灰或石灰乳的理由是 。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为 ,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4和 。
(3)酸性条件下产率偏低的原因是 。
(4)“高温煅烧”滤饼,化学反应方程式为 。
(5)如图是生产羟基磷灰石时得到的实验曲线,依据图上信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用黄铜矿冶炼铜及对炉渣综合利用的一种工艺流程如下:
(1)冶炼过程中得到Cu2O和Cu的混合物称为“泡铜”,其与金属A1在高温条件下混合反应可得粗铜,反应化学方程式为________。粗铜精炼时应将粗铜连接在直流电源的____极,可在____极得到纯度较高的精铜。
(2)传统炼铜的方法主要是火法炼铜,其主要反应为: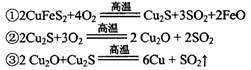
每生成1 mol Cu,共消耗____mol O2。反应③中的氧化剂是____。
(3)炼铜产生的炉渣(含 )可制备Fe2O3。根据流程回答下列问题:
)可制备Fe2O3。根据流程回答下列问题:
①加入适量NaClO溶液的目的是_______ (用离子方程式表示)。
②除去Al3+的离子方程式是____。
③选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂有:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水。所选试剂是____。实验设计:________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
(1)几种盐的溶解度见图。反应III中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、 、洗涤、干燥等操作即得K2SO4产品。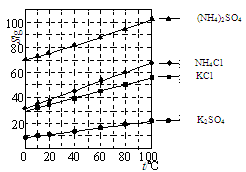
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是: 。
(3)反应IV的化学方程式为 。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为 。
(5)下图是煅烧MnSO4?H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为 。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com