
| A. | 磷酸与烧碱、硝酸与澄淸石灰水 | |
| B. | 氯化钡与硫酸钠、硫酸与硝酸钡 | |
| C. | 碳酸铵与氢氧化钠、碳酸铵与石灰乳 | |
| D. | 纯碱与硫酸、碳酸氢钾与盐酸 |
分析 A.磷酸为弱电解质,离子方程式中不能拆开;
B.二者反应实质都是钡离子与硫酸根离子生成硫酸钡;
C.前者为铵根离子与氢氧根离子生成一水合氨按,后者氢氧化钙不能拆开,且还生成碳酸钙沉淀;
D.纯碱为碳酸钠,碳酸钠电离出碳酸根离子,碳酸氢钾电离出的碳酸氢根离子不能拆开.
解答 解:A.硝酸与澄淸石灰水的反应为:OH-+H+=H2O,而磷酸在离子方程式中不能拆开,二者不能用同一离子方程式表示,故A错误;
B.氯化钡与硫酸钠、硫酸与硝酸钡的离子方程式都是:SO42-+Ba2+=BaSO4↓,故B正确;
C.碳酸铵与氢氧化钠的离子方程式为:OH-+NH4+=NH3•H2O,碳酸铵与石灰乳的反应中,氢氧化钙不能拆开,且反应还生成了碳酸钙沉淀,二者不能用同一离子方程式表示,故C错误;
D.前者离子方程式为:2H++CO32-=H2O+CO2↑,后者离子方程式为:H++HCO3-=H2O+CO2↑,二者不能用同一个离子方程式表示,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,明确离子方程式的书写原则为解答关键,注意掌握离子方程式表示的意义,试题培养了学生的规范答题能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为$\frac{{N}_{A}}{11.2}$ | |
| B. | 通入了1molCl2的新制氯水中,HC1O、Cl一、C1O-粒子数之和为2NA | |
| C. | 含3.0g HCHO的水溶液中原子总数为0.4NA | |
| D. | 3.4gNH3中共用电子对数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Kp=$\frac{P(N{H}_{3})^{4}×P({O}_{2})^{5}}{P(NO)^{4}×P({H}_{2}O)^{6}}$ | |
| B. | 升高温度,若Kp增大,则该反应为吸热反应 | |
| C. | 该反应达到平衡状态后,增大压强,平衡向左移动,Kp减小 | |
| D. | 2NH3(g)+$\frac{5}{2}$O2(g)?2NO(g)+3H2O(g) 的平衡常数Kp=($\frac{1}{2}$)a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
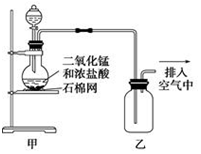
| A. | 该装置图中至少存在两处明显错误 | |
| B. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 | |
| C. | 烧瓶中的MnO2可换成KMnO4 | |
| D. | 在集气瓶的导管口处放一片湿润的淀粉--KI试纸可以证明是否有氯气逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量 Al3+的无色溶液中:Cu2+、Na+、Cl-、SO 42- | |
| B. | 在含有大量 H+的 溶液中:Na+、K+、CO 32-、NO3- | |
| C. | 在强酸的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L H2和D2的混合气体中所含的质子数为NA | |
| B. | 向足量水中通入1mol氯气,反应中转移的电子数为NA | |
| C. | 28g乙烯和丙烯的混合物中所含碳碳双键的数目为NA | |
| D. | 1L0.5mol•L-1Na2CO3溶液中阴离子的总数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
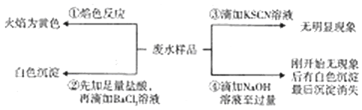
| A. | 废水含有Na+,不含K+ | B. | 废水含有SO42-和CO32- | ||
| C. | 废水不含Fe3+,可能含Fe2+ | D. | 废水一定含有Na+、Al3+、SO42-. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
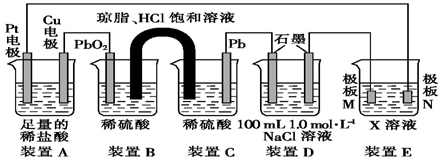
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com