
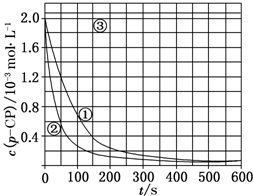
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
分析 (1)对比实验的基本思想是控制变量法,可以在温度相同时,变化浓度,或者在浓度相等时,变化温度;
(2)根据反应速率公式V=$\frac{△c}{△t}$计算平均反应速率;
(3)根据过氧化氢在温度较高时易分解的角度分析;
(4)根据曲线③中溶液pH对反应速率的影响角度判断改变的反应条件.
解答 解:(1)对比实验的关键是控制变量,实验②探究温度对降解反应速率的影响,则②中除了温度不同以外,其它量必须与实验①相同,则温度、双氧水浓度、亚铁离子浓度分别为:313K、6.0、0.30;实验③中除了pH与①不同外,其它量完全相同,则探究的是溶液的pH对降解反应速率的影响,
故答案为:
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 探究温度对降解反应速率的影响 | 313 | 6.0 | 0.30 | |
| ③ | 探究溶液的pH对降解反应速率的影响 | ||||
点评 本题考查化学反应速率的影响因素,题目难度中等,注意掌握影响化学反应速率的因素,明确设计对比实验时,只能改变一个条件,否则无法确定影响因素,试题培养了学生的分析、理解能力及化学实验能力.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
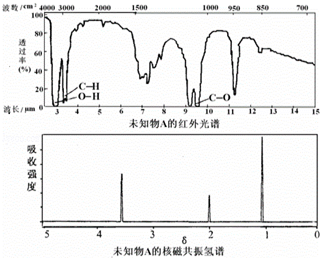
| A. | 由红光外谱可知,该有机物中有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有两种不同化学环境的氢原子 | |
| C. | 仅由核磁共振氢谱即可得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | A | B | C | D |
| 起始投料(mol) | 2 | 1 | 2 | 0 |
| A. | 该反应的△H>0 | B. | 温度升高,该反应的平衡常数减小 | ||
| C. | 到达平衡时,n(B)=0.5 mol | D. | 平衡后,增加D的量,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
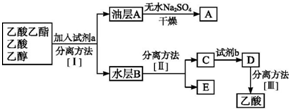 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
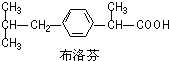
| A. | 布洛芬的分子式C13H18O2 | |
| B. | 布洛芬与苯乙酸(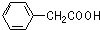 )是同系物 )是同系物 | |
| C. | 布洛芬苯环上的一氯代物有2种 | |
| D. | 常温条件下,1 mol布洛芬完全与金属钠反应可得到1 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | 碱金属元素是指ⅠA族的所有元素 | |
| D. | 副族元素中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入足量的高锰酸钾溶液,然后再加溴水 | |
| B. | 加入浓硫酸和浓硝酸后再加热 | |
| C. | 先加入足量的溴水,然后再加入高锰酸钾酸性溶液 | |
| D. | 点燃这种液体,然后再观察火焰的明亮程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的熔点较高 | B. | Z可以表示为M2Y | ||
| C. | Z可能易溶于水 | D. | M形成+2价的阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
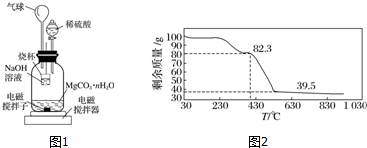
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com