
【题目】(1)已知2H→H2放出437.6 kJ的热量,下列说法正确的是____
A.氢气分子内每个氢原子都达到稳定结构
B.氢气分子的能量比两个氢原子的能量低
C.1molH2离解成 2 mol H 要放出437.6 kJ热量
D.氢原子比氢气分子稳定
(2)科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O![]() 2H2↑+O2↑。制得的氢气可用于制作燃料电池.试回答下列问题:
2H2↑+O2↑。制得的氢气可用于制作燃料电池.试回答下列问题:
①分解海水时,实现了光能转化为__能;生成的氢气用于制作燃料电池时,实现了化学能转化为____能;分解海水的反应属于___反应(填“放热”或“吸热”)
②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为:2H2+2O24e=2H2O,则B极的电极反应式为:____
(3)已知某电池的总反应为:Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O,写出该电池的电极反应方程式:负极_______正极_______
【答案】AB 化学 电 吸热 O2 +4e =2O2 负极:Zn – 2e = Zn2+ 正极:2NH4+ +2MnO2+ 2e=2NH3↑+Mn2O3+H2O
【解析】
(1)A、氢气分子内每个氢原子都达到2电子稳定结构,选项A正确;
B、2molH结合成1molH2放出能量,则H2分子的能量比两个H原子的能量低,选项B正确;
C、根据已知2H→H2并放出437.6kJ的热量,所以1molH2离解成2molH要吸收437.6kJ的热量,选项C错误;
D、原子比分子能量高,氢气分子稳定,选项D错误;
答案选AB;
(2)①利用太阳能产生激光分解海水时,实现了光能转化为化学能;生成的氢气用于制作燃料电池时,化学能又转化为电能;分解海水的反应属于吸热反应;
②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为2H2+ 2O2- -4e-=2H2O,该反应为氧化反应,则A极是电池的负极,电子从该极流出,B极为正极,发生还原反应,电极反应式为O2+4e-=2O2-;
(3)在反应中Zn元素化合价升高,被氧化,Zn为负极反应,负极电极反应式为Zn – 2e = Zn2+,Mn元素化合价降低,被还原,MnO2为正极反应,正极反应式为2NH4+ +2MnO2+ 2e=2NH3↑+Mn2O3+H2O。


科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,可能的原因是_____________(合理均可);C装置的作用___________________。
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:B:_______________,D:________________。
(3)若将B中品红换成H2S溶液,通SO2一段时间后B中现象为_____,该反应的化学方程式为______,其中氧化产物与还原产物的物质的量之比为________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A. 用20mL量筒量取15mL酒精,加水5mL,配制质量分数为75%的酒精溶液(ρ<1)
B. 实验中需用2.0mol·L-1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分数分别为950mL、201.4g
C. 在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为2.5mol·L-1
D. 实验室配制500mL 0.2mol·L-1的硫酸亚铁溶液,其操作是:用天平称15.2g绿矾(FeSO47H2O),放入小烧杯中加水溶解,转移到500mL容量瓶、稀释、定量、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C内分别充入等质量的X、CO2、Y三种气体,当隔板静止时,A、C内的气体密度相等。下列说法不正确的是

A. 物质的量:n(X)<n(CO2)<n(Y)
B. 分子数目:N(X)=N(Y)
C. 气体的体积:V(X)=V(Y)
D. 摩尔质量:M(X)=M(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)=C(g)+D(g),过程中的能量变化如图所示,下列说法中正确的是( )
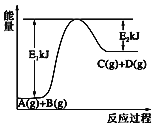
A. A的能量一定低于C
B. 反应物断键吸收的总能量大于产物新键形成放出的总能量
C. 化学反应中的能量变化都表现为热量的变化
D. 1mol气体A和1mol气体B反应生成1mol气体C和1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验能获得成功的是( )
A.用酸性高锰酸钾溶液鉴别乙烯和乙炔
B.将稀硫酸、稀硝酸和苯混合加热制硝基苯
C.苯和硝基苯混合物采用分液的方法分离
D.用氢氧化钠溶液除去溴苯中含有的杂质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某 NaOH 溶液中通入 CO2 气体后得到溶液 M,因 CO2 通入的量不同, 溶液 M 的组成也不同,若向溶液 M 中逐滴加入盐酸,产生的气体体积 V(CO2)与加入盐酸的体积 V(HCl)的关系如图所示。则下列分析与判断 不正确的是(不计CO2溶解)
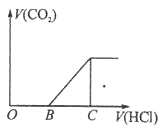
A. 若 OB=0,则形成溶液的过程中所发生反应的离子方程式为OH-+CO2=HCO3-
B. 若 OB=BC,则溶液 M 为Na2CO3 溶液
C. 若 OB>BC,则溶液 M 中大量存在的阴离子为 CO32-和HCO3-
D. 若 3OB=BC,则溶液 M 中 c(NaHCO3)=2c(Na2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com