
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③④⑦ | C. | ①②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+FeSO4═Fe+CuSO4 | B. | 2HCl+Na2SO4═H2SO4+2NaCl | ||
| C. | CaCO3+2HCl═CaCl2+CO2↑+H2O | D. | 2Ag+2HCl═2AgCl↓+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
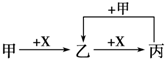
| A. | 甲为Fe、X为Cl2 | B. | 甲为S、X为O2 | ||
| C. | 甲为SO2、X为NaOH溶液 | D. | 甲为AlCl3溶液、X为NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5L | B. | 0.1L | C. | 2L | D. | 1L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用前要检查容量瓶是否漏水 | |
| B. | 容量瓶上标明了规格、温度和浓度 | |
| C. | 容量瓶用蒸馏水洗净后,要烘干水分后才能使用 | |
| D. | 配制好溶液后,要在容量瓶上贴上标签,保存备用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
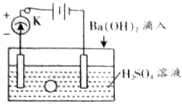 如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电能力的关系装置图.
如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电能力的关系装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com