
| A. | Pb为正极被氧化 | B. | SO42-只向PbO2处移动 | ||
| C. | Pb电极质量减少 | D. | 电解质溶液的pH不断增大 |
分析 由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,
电极反应式为Pb-2e-+SO42-=PbSO4,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,原电池中阳离子向正极移动,阴离子向负极移动.
解答 解:A.由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,Pb为负极,发生失电子的氧化反应,被氧化,故A错误;
B、原电池中阳离子向正极移动,阴离子硫酸根向负极Pb极移动,故B错误;
C、Pb被氧化,应为电池负极反应,电极反应式为Pb-2e-+SO42-=PbSO4,质量减少,故C错误;
D、由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,硫酸被消耗,pH不断增大,故D正确.
故选D.
点评 本题考查原电池的工作原理,题目难度中等,本题注意电极反应式的书写,为解答该题的关键.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题


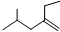 的系统命名4-甲基-2-乙基-1-戊烯
的系统命名4-甲基-2-乙基-1-戊烯查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
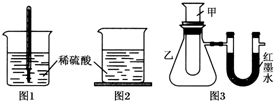
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氨气是弱电解质,铜是强电解质 | |
| C. | 体积和氢离子浓度都相同的盐酸和醋酸溶液中和同种NaOH溶液,消耗氢氧化钠一样多 | |
| D. | 等浓度等体积的盐酸和醋酸溶液中和同种NaOH溶液,消耗氢氧化钠一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化钙是一种强氧化剂 | |
| B. | 加热时,氢化钙能跟干燥氧气反应生成水 | |
| C. | 氢化钙(CaH2)是离子化合物,固体中含H-H键 | |
| D. | 可以取少量试样滴加几滴水,检验反应是否产生氢气来区别金属钙与氢化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com