
| A、用量筒量取所需的浓硫酸时仰视读数 |
| B、定容后摇匀,发现液面最低点低于刻度线,再补加几滴蒸馏水至刻度线 |
| C、定容时,俯视刻度线 |
| D、用量筒量取浓硫酸倒入烧杯,再用蒸馏水洗量筒2~3次,洗液倒入烧杯中 |
| n |
| V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行元素分析,测得粉末中K和S两种元素的质量比为39:16,则该粉末没有变质 |
| B、将粉末溶于水,加入氯化钡,有白色沉淀生成,则该粉末变质了 |
| C、将粉末加入盐酸中,产生气泡,则该粉末没有变质 |
| D、将粉末溶于水,滴加过量的盐酸,有气泡产生,再加入氯化钡溶液,有白色沉淀生成,则该粉末部分变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
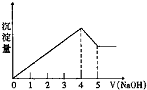 有一镁、铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量随氢氧化钠的体积关系如图所示,原合金中镁、铝质量比为( ) (Mg、Al的相对原子质量分别为24、27)
有一镁、铝合金,用适量稀硫酸完全溶解,再加入氢氧化钠溶液,析出沉淀的质量随氢氧化钠的体积关系如图所示,原合金中镁、铝质量比为( ) (Mg、Al的相对原子质量分别为24、27)| A、4:3 | B、4:9 |
| C、8:9 | D、20:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5:7 | B、7:5 |
| C、1:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀盐酸 |
| B、KNO3溶液 |
| C、CuSO4溶液 |
| D、稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,同一时间内阳极溶解的粗铜的质量比阴极析出的铜的质量大 |
| B、在镀件上电镀锌,可以用锌做阳极,也可以用惰性材料做阳极 |
| C、二次电池充电过程是化学能转化为电能的过程 |
| D、二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com