
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为____________________。
(2)与OH-互为等电子体的一种分子为______________(填化学式)。
(3)醛基中碳原子的轨道杂化类型是________;1 mol乙醛分子中含有的σ键的数目为________。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为__________________________。

(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
(1)[Ar]3d10或1s22s22p63s23p63d10
(2)HF (3)sp2 6 mol或6×6.02×1023个
(4)2Cu(OH)2+CH3CHO+NaOH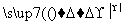 CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
(5)12
[解析] (1)Cu为29号,Cu+核外还有28个电子,按照核外电子排布规律,应为[Ar]3d10或1s22s22p63s23p63d10。(2)OH-含有10个电子,根据等电子体的含义,可知10电子的双原子分子为HF。(3)—CHO中含碳氧双键,为平面结构,故中心原子碳原子采取sp2杂化。 1 mol CH3CHO中含有5 mol单键、1 mol双键,故含σ键为5 mol+1 mol=6 mol。(4)Cu(OH)2被CH3CHO还原为Cu2O,CH3CHO被氧化为CH3COOH,再与NaOH反应生成CH3COONa,故反应为2Cu(OH)2+CH3CHO+NaOH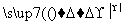 CH3COONa+Cu2O↓+3H2O。(5)铜晶胞为面心立方晶胞,故每个铜原子周围距离最近的铜原子为4×3=12。
CH3COONa+Cu2O↓+3H2O。(5)铜晶胞为面心立方晶胞,故每个铜原子周围距离最近的铜原子为4×3=12。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
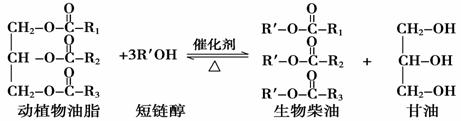
下列叙述错误的是( )
A.生物柴油由可再生资源制得 B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物 D.“地沟油”可用于制备生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,25 ℃时AgCl固体在下列四个选项中,溶解度最大的是( )
A.100 mL 0.01 mol/L KNO3溶液
B.100 mL 0.01 mol/L 盐酸
C.100 mL 0.01 mol/L AgNO3溶液
D.100 mL 0.01 mol/L KI溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题;
(1)b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示意图为________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为______;分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是________;酸根呈三角锥结构的酸是________。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图(a),则e离子的电荷为________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。
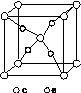
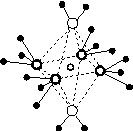
(a) (b)
该化合物中,阴离子为________,阳离子中存在的化学键类型有________;该化合物加热时首先失去的组分是________,判断理由是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。
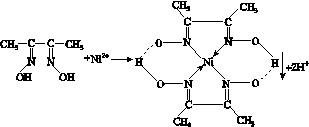
A
(1)基态Ni2+的核外电子排布式为________________________________________________________________________。
(2)丁二酮肟的组成元素中C、N、O的电负性由大到小的顺序为________。丁二酮肟分子中C原子的杂化轨道类型是________。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图K333所示,则该化合物的化学式为________。

图K333
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3 ℃。Ni(CO)4的晶体类型是________。请写出1种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2
 C.CH3CH2OH D.CH3CH2Br
C.CH3CH2OH D.CH3CH2Br
 (4)已知 2CH3CHO+O2 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
(4)已知 2CH3CHO+O2 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
反应②的化学方程式为____________________________________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____________________________________,反应类型是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下图所示的四个原电池装置,结论正确的是( )
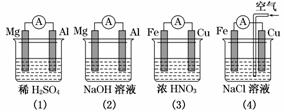
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为:6H2O+6e-===6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为:Fe-2e-===Fe2+
D.(4)中Cu作正极,电极反应式为:2H++2e-===H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com