
【题目】19.2 g Cu加入到100 mL一定浓度的硝酸溶液中,假定两者恰好完全反应,同时产生标准状况下8.96 L NO和NO2的混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO和NO2的体积比。_____________
(2)硝酸溶液的物质的量浓度。__________________
【答案】1∶3 10.0 mol/L
【解析】
(1)从氧化还原反应得失电子数目相等的角度计算;
(2)反应后溶液为硝酸铜,结合N元素守恒计算。
(1)设反应产生的NO2物质的量为xmol,NO物质的量为ymol,根据N原子守恒可得x+y=![]() =0.4mol,n(Cu)=19.2g÷64g/mol=0.3mol,Cu是+2价的金属,则根据电子守恒可得x+3y=2×0.3mol=0.6mol,解得:x=0.3mol,y=0.1mol,则n(NO):n(NO2)=0.1mol:0.3mol=1:3。在同温同压下,气体的体积比等于气体的物质的量的比,所以V(NO):V(NO2) =1:3;
=0.4mol,n(Cu)=19.2g÷64g/mol=0.3mol,Cu是+2价的金属,则根据电子守恒可得x+3y=2×0.3mol=0.6mol,解得:x=0.3mol,y=0.1mol,则n(NO):n(NO2)=0.1mol:0.3mol=1:3。在同温同压下,气体的体积比等于气体的物质的量的比,所以V(NO):V(NO2) =1:3;
(2)在反应中HNO3发生反应转化为Cu(NO3)2、NO2、NO,据N原子守恒:n(HNO3)=2n[Cu(NO3)2)+n(NO2)+n(NO)=2×0.3mol+0.3mol+0.1mol=1.0mol,所以硝酸的物质的量浓度c(HNO3)=![]() =10.0mol/L。
=10.0mol/L。


科目:高中化学 来源: 题型:
【题目】Ⅰ、已知下面在298K时的热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,CH4(g)+2O2(g)=CO2(g)+2H2O (l) ΔH=-890.3 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1。根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是___。
(2)根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=___。
(3)已知H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:___。
Ⅱ、为了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
(1)分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是___。
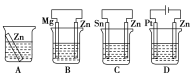
(2)利用如图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学防护法称为___。
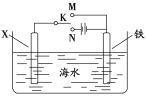
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请据如下实验方案回答问题。

(1)操作1的名称是_________;
(2)反应①中加入略过量的A物质的目的是_________________________;判断A已过量的实验操作方法是________________________。
(3)写出反应②的化学方程式:______________________________。如果加入盐酸过量,则对所得到的氯化钠的纯度_________(填“有”或“没有”)影响。
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g,则样品中NaCl的质量分数是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个铝制易拉罐充满![]() 后,再往罐内注入足量的
后,再往罐内注入足量的![]() 溶液,立即用胶布严封罐口,不多会儿就会听到罐内“咔、咔”作响,发现易拉罐变瘪,再过一会儿易拉罐又鼓涨起来,解释上述变化的实验现象.
溶液,立即用胶布严封罐口,不多会儿就会听到罐内“咔、咔”作响,发现易拉罐变瘪,再过一会儿易拉罐又鼓涨起来,解释上述变化的实验现象.
(1)易拉罐开始变瘪的原因是___________,其离子方程式(或化学方程式)为___________.
(2)易拉罐后来又鼓涨起来的原因是_____________,其离子方程式(或化学方程式)为_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究氨的还原性及检验产物的性质,按下图装置进行实验(图中夹持装置已略去)。将B处的三氧化二铬加热至红热,再鼓入空气,已知:无水氯化钙可吸收氨气和水。回答下列问题:
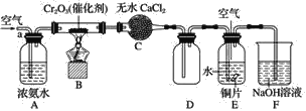
(1)B中发生反应的化学方程式是______________________________。
(2)证明氨气发生催化氧化的现象是________________,反应的方程式是________________。
(3)E中铜发生反应的离子方程式是________________________________。
(4)E中缓缓通入空气的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列叙述正确的是
A. 78g苯中含有的碳碳双键的数目为3NA
B. 16gCu2S和CuO组成的混合物中含有的阳离子数为0.2NA
C. 将1mol H2与 1 mol I2充入一密闭容器中充分反应后,转移的电子书为2NA
D. 1 mol Fe 与足量的浓硫酸共热反应,生成SO2的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
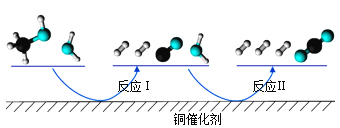

下列说法正确的是( )
A.反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.选择优良的催化剂降低反应Ⅰ和Ⅱ的活化能,有利于减少过程中的能耗
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式______________________________________________________。
(2)已知:C(s)+O2(g) = CO2(g) △H=-437.3kJ·mol -1
H2(g)+1/2O2(g) = H2O(g) △H=-285.8kJ·mol-1
CO(g)+1/2O2(g) = CO2(g) △H=-283.0kJ·mol-1
则煤气化反应C(s)+H2O(g) = CO(g)+H2(g)的焓变△H=___________ kJ·mol-1。
(3)人们利用原电池原理制作了多种电池,以满足日常生活、生产和科学技术等方面的需要。请根据题中提供的信息,回答下列问题。
①铅蓄电池在放电时的电池反应为Pb+PbO2+2H2SO4==2PbSO4+2H2O,则其正极上的电极反应为________________________________________________________。
②FeCl3溶液腐蚀印刷电路铜板时发生反应:2FeCl3+Cu==2FeCl2+ CuCl2。若将此反应设计成原电池,则负极所用的电极材料为_____;电极反应式:_________________。
③已知甲醇燃料电池的工作原理如下图所示。该电池工作时,b口通入的物质为_____,该电池正极上的电极反应式为___________________;当6.4g甲醇(CH3OH)完全反应生成CO2时,有___ mol电子发生转移。若将电池的电解质溶液换为KOH溶液,则负极的电极方程式为______________________。
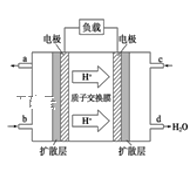
(4)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式为_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com