
| A. | Cu(OH)2中加入硫酸:OH-+H+=H2O | |
| B. | 钠加入水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+ | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=H2O+BaSO4↓ |
分析 A.氢氧化铜为难溶物,离子方程式中不能拆开;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.铁与氯化铜溶液反应生成氯化亚铁和铜;
D.氢离子、氢氧根离子的计量数错误.
解答 解:A.Cu(OH)2中加入硫酸,氢氧化铜不能拆开,正确的离子方程式为:Cu(OH)2+2H+=2H2O+Cu2+,故A错误;
B.钠加入水中生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.铁片与氯化铜溶液反应的离子方程式为:Fe+Cu2+=Cu+Fe2+,故C正确;
D.向Ba(OH)2溶液中滴加稀硫酸,正确的离子方程式为:Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:选择题
| A. | C3H8(l)+5O2(g)═3CO2(g)+4H2O(l)△H=-2219.9 kJ/mol | |
| B. | 2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ/mol | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
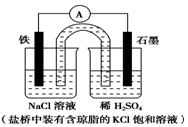
| A. | 电池工作中,盐桥的中Cl-向负极移动 | |
| B. | 负极反应:2H++2e-═H2↑ | |
| C. | 工作一段时间后,两烧杯中溶液pH均不变 | |
| D. | Fe作正极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L N2和H2混合气体中含N个原子 | |
| B. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| C. | 1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1N | |
| D. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2N |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
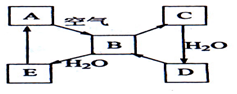 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C含有的元素种类相同,且相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C含有的元素种类相同,且相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的硫磺和甲基苯酚都可以添加到肥皂中做消毒剂 | |
| B. | 可以通过煤的干馏得到苯、二甲苯等化工原料粗品 | |
| C. | 神州十一号航天员的航天服由碳化硅陶瓷和碳纤维复合制成,它是一种新型无机复合材料 | |
| D. | 经过一定化学变化,可以从海水中提取氯化钠或镁等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| N2 | H2 | NH3 | |
| 起始物质的量(mol) | 2 | 2 | 0 |
| A. | 平衡时NH3的物质的量:0mol<n(NH3)<$\frac{4}{3}$mol | |
| B. | 平衡时,N2的转化率为$\frac{α}{3}$ | |
| C. | 现将容器体积压缩到原来的一半,再次到达平衡之后,N2的体积分数变小 | |
| D. | 其他条件不变,若起始充入 N2、H2、NH3的物质的分别为:1.5mol、0.5mol、1mol,则到达平衡时,NH3的体积分数为x% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com