
| A. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| B. | 相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E1>E2 | |
| C. | 101kPa时,2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,H2的燃烧热为571.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,含1molNaOH的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |
分析 A、石墨完全转化为金刚石时,要吸收能量,说明金刚石能量高于石墨,能量越低越稳定;
B、原子能量高于分子能量,形成化学键放出能量;
C、燃烧热是指完全燃烧1mol物质生成稳定的产物所放出的热量;
D、中和热是强酸和强碱发生中和反应生成1mol水时,所放出的热量.
解答 解:A、石墨完全转化为金刚石时,要吸收能量,说明金刚石能量高于石墨,能量越低越稳定,所以石墨比金刚石稳定,故A错误;
B、原子能量高于分子能量,形成化学键放出能量,相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E1>E2,故B正确;
C、燃烧热是指完全燃烧1mol物质生成稳定的产物所放出的热量,由此可知氢气的燃烧热为285.8kJ,故C错误;
D、中和热是强酸和强碱发生中和反应生成1mol水时,所放出的热量,1molNaOH的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合时,浓硫酸溶于水放热,所以导致△H<-57.3kJ•mol-1,故D错误;
故选B.
点评 本题考查了物质能量的高低与反应能量变化的关系、能量转化的形式以及燃烧热的概念、热化学方程式的意义等知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3的浓度不再发生改变 | |
| B. | 容器内N2、H2、NH3的浓度之比为1:3:2 | |
| C. | 容器内的压强不再发生改变 | |
| D. | 单位时间内消耗1 mol N2的同时消耗了2 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C位于第二周期且相邻 | |
| B. | AC2、BC2、DC2、EC2四种物质的晶体类型相同 | |
| C. | A、B、C、D、E五种元素与H形成的最简单氢化物中,C的氢化物最稳定 | |
| D. | A的一种单质是天然最硬的矿物,C和D分别是地壳中含量第一、二的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:H2O>H2S | B. | 碱性:KOH>NaOH | ||
| C. | 酸性:HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{14}$mol/L | B. | $\frac{4}{5}$mol/L | C. | $\frac{1}{28}$mol/L | D. | $\frac{1}{42}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5Cl→CH2=CH2 | B. | CH3CHO→C2H5OH | ||
| C. |  | D. | CH3COOH→CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Z的气态氢化物的稳定性在同主族元素中最强 | |
| B. | W的最高价氧化物对应的水化物是强酸 | |
| C. | W的非金属性比Z的弱 | |
| D. | Y的原子半径在同周期主族元素中最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
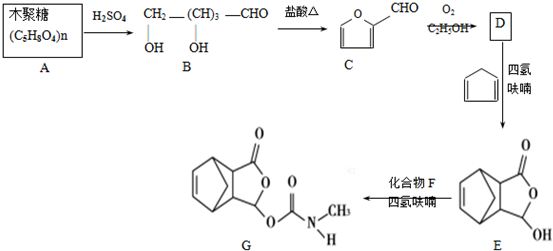
 ,在流程中作反应的催化剂;
,在流程中作反应的催化剂; ;
;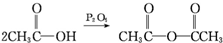 .
. 、CH3NHCOOH.
、CH3NHCOOH. .
. .
.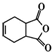 )是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3-丁二烯为原料制备H的合成路线流程图(无机试剂任用):
)是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3-丁二烯为原料制备H的合成路线流程图(无机试剂任用): .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲一定是强碱 | B. | 乙一定是弱碱 | C. | 乙一定是二元碱 | D. | 甲一定是一元碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com