
| A. | 溶液中含有OH- | B. | 滴加甲基橙后溶液显红色 | ||
| C. | 溶液中c(OH-)>c(H+) | D. | 滴加甲基橙后溶液显黄色 |
分析 只要溶液中存在c(OH-)>c(H+),则该溶液一定呈碱性;如果溶液中存在c(OH-)=c(H+),则溶液呈中性;如果溶液中存在c(OH-)<c(H+),则溶液呈酸性,只能根据溶液中c(OH-)、c(H+)相对大小判断溶液酸碱性.
解答 解:A.任何电解质水溶液中都含有OH-,所以含有OH-的溶液不一定呈碱性,故A错误;
B.甲基橙的变色范围为3.1-4.4,所以滴加甲基橙后溶液显红色的溶液呈酸性,故B错误;
C.溶液中c(OH-)>c(H+),则该溶液中一定呈碱性,故C正确;
D.甲基橙变色范围为3.1-4.4,所以滴加甲基橙溶液显黄色的溶液可能呈酸性、中性或碱性,故D错误;
故选C.
点评 本题考查电解质溶液酸碱性判断,为高频考点,只能根据溶液中c(OH-)、c(H+)相对大小判断溶液酸碱性,温度未知时不能根据溶液pH判断酸碱性,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应放出的热量为0.2akJ | |
| B. | 平衡时H2O的转化率为60% | |
| C. | 升高温度,v(正)加快v(逆)减慢,平衡正向移动 | |
| D. | 将容器的体积压缩为1L,H2的体积分数变为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
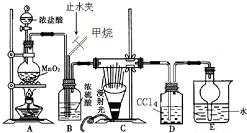 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图: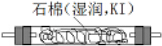 B.
B.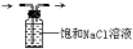 C.
C.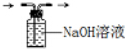
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同 | |
| B. | 无法比较 | |
| C. | 依次为0.12mol/L、0.24mol/L、0.36mol/L | |
| D. | 依次为0.06mol/L、0.12mol/L、0.18mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q3-Q2+3 Q1 | B. | Q3+Q2+Q1 | C. | 3Q3-Q2+Q1 | D. | Q2-Q3+3 Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向正反应方向移动,c(H+)增大 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动,c(H+)减少 | |
| C. | 加入少量0.1mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动,c(CH3COO-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
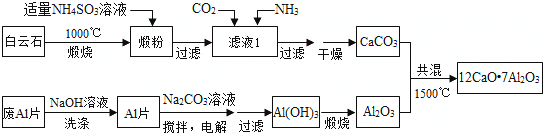
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com