
【题目】物质氧化性、还原性的强弱,不仅与物质的结构有关,还与浓度和反应温度有关,下列各组物质由于浓度不同而发生不同反应的是:
A. Cu与HNO3 B. Cu与FeCl3 C.Zn与HCl D.FeCl3与NaOH
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是______________。若电解电路中通过2mol电子,MnO2的理论产量为______ 克。
(2)高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑,则电解时阳极的电极反应式是_____________________。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是_____________________。
(3)用惰性电极电解100ml4mol/L的Cu(NO3)2溶液,一段时间后在阳极收集到标况下气体1.12L,
停止电解,向电解后的溶液中加入足量的铁粉,充分作用后溶液中Fe2+浓度为(设溶液体积不
变)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的酸性溶液中,能大量共存的离子组是
A. Na+ 、K+、SO42-、CO32- B. Al3+、K+、SO42-、OH
C. Na+、 K+、Cl、 NO3 D. K+、Fe3+、MnO4-、I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前三周期:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0[ | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三[ | G | H | I | J |
回答下列问题:
(1)J元素的元素的名称:___________。
(2)G元素与I 元素形成的化合物的电子式是___________,
A、G、E形成的化合物中含有的化学键类型为_____________________________。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,
属于两性氢氧化物的是_______________(用化合物的化学式表示)。
(4)将H单质与C的一种单质(导体)按如下图装置连接,其中C极为_________极(填正或负),并写出该电极反应式为:____________________。
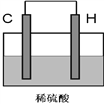
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A能发生以下转化,并且A可以作为水果的催熟剂,在一定条件下A可以发生自身加成反应,形成高分子化合物E.
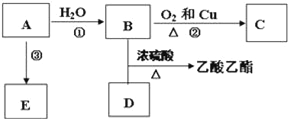
(1)写出E的结构简式______,E______(填“能”或“不能”)使酸性KMnO4溶液褪色.
(2)请写出C的名称是______,D分子中的官能团名称是______.
(3)请写出反应②以及B与D发生反应的化学方程式,并注明反应类型:
②______,反应类型______;
B+D______,反应类型______.
(4)若完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式______,并写出其所有可能的结构简式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A. 用铜电极电解NaCl溶液制备Cl2:2C1—+2H2O![]() Cl2↑+H2↑+2OH—
Cl2↑+H2↑+2OH—
B. 向MgCl2溶液中加入氨水制备Mg(OH)2:Mg2++2OH—==Mg(OH)2↓
C. 将FeS溶于稀硝酸制备Fe(NO3)3:FeS+4H++NO3==Fe3++NO↑+S↓+2H2O
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4—+6H++5H2O2==2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液。下列说法正确的是( )

A. a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. b电极上发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com