
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
|
| A. | 同一元素不可能既表现金属性,又表现非金属性 |
|
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 |
|
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 |
|
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
考点:
原子结构与元素的性质.
分析:
A、根据周期表中金属性、非金属性的变化规律来考虑;
B、根据同周期元素化合价的变化规律来判断;
C、注意第一周期只有两种元素;
D、根据同族元素的性质的变化规律判断.
解答:
解: A、处于金属和非金属分界线的元素既有金属性又有非金属性,如硅元素,A选项错误;
B、第三周期的元素从Na到Cl最高化合价从正一价到正七价和族序数相等,B选项正确;
C、H元素、Li元素形成离子后达到2电子结构和氦结构相同,不是8电子稳定结构,C选项错误;
D、第一主族的所有元素最外层都为一个电子,但是H元素与Na元素性质差异很大,同一主族的元素的原子,最外层电子数相同,化学性质相似,D选项错误.
故选B.
点评:
此题考查了元素周期律知识.对此类题目既要考虑元素在周期表中的位置、元素的原子结构和性质之间的关系,又要注意规律的特殊性,如核外电子排布的周期性变化中,第一周期最外层电子数从1→2,而不是从1→8的变化;同周期化合价变化规律中,第2周期的F、O不符合;第一电离能变化规律中,同周期的ⅡA族和ⅢA族、ⅤA族和ⅥA族存在反常等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
(1)请按照下面的实验步骤制备氢氧化铁胶体,检验胶体的性质,首先用烧杯取少量蒸馏水,用酒精灯加热至沸腾,然后逐滴向烧杯中滴加FeCl3饱和溶液,并继续煮沸至液体呈透明的红褐色即得氢氧化铁胶体.写出制备Fe(OH)3胶体的化学方程式 ,怎样检验你是否制得了胶体?(写出具体操作) .
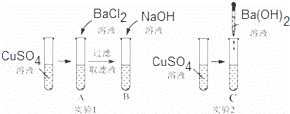
(2)仔细分析如图中的实验:
A、B、C试管中的现象如下表所示:
| A | B | C |
| 产生白色沉定,溶液仍为蓝色 | 产生蓝色沉定,溶液变为无色 | 产生蓝色沉淀,溶液为无色 |
写出A、B、C试管中发生反应的离子方程式:
A. ;B. .C. .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验或反应中,最后固体质量增加的是( )
A.铜丝在空气中灼烧后迅速伸入乙醇蒸气中
B.铁粉与硫粉物质的量之比为1:1时混合加热
C.锌粉加入到氯化铜溶液中
D.去除氧化膜的铝条插入到浓硝酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是
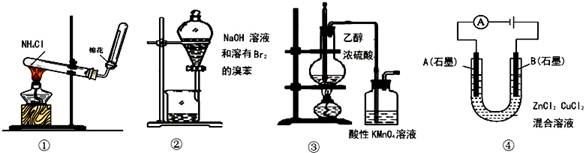
| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
| D | ④通电 | B极上有红色固体析出 | 锌的金属性比铜强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
| |
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)充分焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
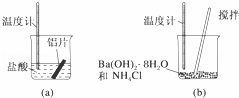
(1)某同学做如下实验,以检验反应中的能量变化.
实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是 热反应;(b)中温度降低,根据能量守恒定律,(b)中反应物的总能量应该 其生成物的总能量.
(2)下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银.其中(用序号填空):
能设计成原电池的反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
0.80gCuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
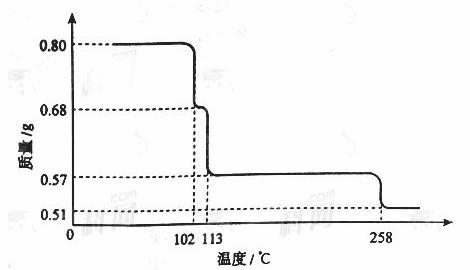
请回答下列问题:
(1)试确定200℃时固体物质的化学式______________(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________,其存在的最高温度是_____________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为________________;
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________m ol·L-1(Kap[Cu(OH)2]=2.2×10-20)。若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
ol·L-1(Kap[Cu(OH)2]=2.2×10-20)。若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
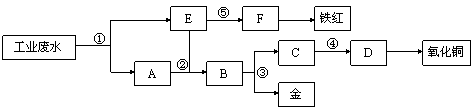
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤  ;
;
(2)写出①处发生反应的离子方程式 ;写 出③处发生反应的化学方程式 ;
出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com