
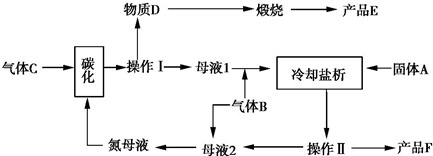
分析 (1)根据“海水晒盐”原理是利用蒸发溶剂的方法使溶质氯化钠析出的过程来回答;晒盐过程中没有发生化学变化;
(2)①有效除去工业食盐中的Ca2+、Mg2+、SO42-,选NaOH除去镁离子,选氯化钡除去硫酸根离子,选碳酸钠除去钡离子、钙离子,则碳酸钠一定在氯化钡之后,最后加适量盐酸;
②阳离子交换膜只能阳离子通过,阴离子和气体不能通过;
③氢气和氯气的状态都是气态,运输不方便,且容易发生爆炸现象;
(3)产品E和F为碳酸钠和氯化铵,物质E煅烧后得到E,则D为碳酸氢钠,E为碳酸钠;故F为氯化铵;根据“在析出碳酸氢钠后的母液中继续加入食盐,通入氨气,使氯化铵析出”可知,固体A为NaCl、B为NH3;加入气体C碳化,则气体C为二氧化碳,据此进行解答.
解答 解:(1)蒸发是升高温度让一种物质挥发出来,而剩余另一物质的方法,类似“海水晒盐”原理;该过程中没有发生化学反应,属于物理变化,
故答案为:蒸发;物理;
(2)①有效除去工业食盐中的Ca2+、Mg2+、SO42-,选NaOH除去镁离子,选氯化钡除去硫酸根离子,选碳酸钠除去钡离子、钙离子,则碳酸钠一定在氯化钡之后,最后加适量盐酸,则合理的顺序为先加NaOH,后加BaCl2,再加Na2CO3或先加BaCl2,后加NaOH,再加Na2CO3,属于bc正确,
故答案为:bc;
②阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯,
故答案为:阻止气体分子和某些离子通过,防止H2和Cl2混合发生爆炸,并能避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量;
③由于氯气和氢气作为气体,运输和贮藏困难相当大,且运输过程中还存在很大的安全隐患,所以氯碱工业的选址通常与农药厂、有机化工厂、制药厂、盐酸厂等建在一起,
故答案为:氯气和氢气作为气体,运输和贮藏困难相当大,运输过程中还存在很大的安全隐患;
(3)产品E和F为碳酸钠和氯化铵,物质E煅烧后得到E,则D为碳酸氢钠,E为碳酸钠;故F为氯化铵;根据“在析出碳酸氢钠后的母液中继续加入食盐,通入氨气,使氯化铵析出”可知,固体A为NaCl、B为NH3;加入气体C碳化,则气体C为二氧化碳,
①根据分析可知,气体B为NH3;二氧化碳在水中的溶解度较小,氨气极易溶于水,通入NH3使溶液呈碱性,增大CO2的溶解度,才能产生足够多的HCO3-,以确保得到NaHCO3沉淀,所以应该先通氨气后通入二氧化碳,
故答案为:NH3; 氨气;二氧化碳;
②根据制备流程可知,循环利用的物质有:A氯化钠、B氨气、C二氧化碳、D碳酸氢钠和F氯化铵,故答案为:A;D.
点评 本题考查了氯碱工业、物质制备原理,题目难度中等,明确制备流程及反应原理为解答关键,注意掌握侯氏制碱法原理,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ①0.6 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ②ν正>ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态下,1molNa2O2完全电离出的离子数目为3NA(NA代表阿伏加德罗常数的值) | |
| B. | 酸性氧化物不一定是非金属氧化物,碱性氧化则一定是金属氧化物 | |
| C. | 常温下醋酸分子不可能存在于pH>7的碱性溶液中 | |
| D. | 第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、O3 | B. | H2、D2、T2 | C. | H2O、D2O、T2O | D. | ${\;}_{1}^{1}$H ${\;}_{1}^{2}$H |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com