
| 实验操作 | 实验现象 | 结论 | |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | |||
| ②过滤,取2mL滤液于试管中 | |||
| ③ | |||
| ||
| 1 |
| 2 |
| 实验操作 | 实验现象 | 结论 |
| ①-- ③滴加酚酞 | 产生白色沉淀 溶液变红 | 有CO32- 有OH- |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
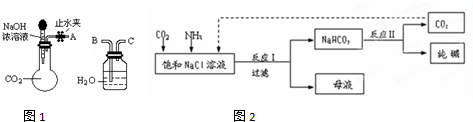
 某有机物的相对分子质量为70,1H核磁共振谱如图所示(峰面积之比为1:1:1:3),分析核磁共振图谱,回答下列问题
某有机物的相对分子质量为70,1H核磁共振谱如图所示(峰面积之比为1:1:1:3),分析核磁共振图谱,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20% | B、25% |
| C、33% | D、50% |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题 | ||||||
| B、加速建设城市地铁、轻轨等轨道交通,促进城市一体化发展,减少汽车尾气排放 | ||||||
| C、发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统 | ||||||
D、尽量使用含
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、采用绿色工艺,使原料尽可能转化为所需物质 |
| B、大量开采地下水,以满足社会需求 |
| C、开发利用绿色能源替代化石燃料 |
| D、严格执行机动车尾气排放标准 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①-d | B、②-a |
| C、③-c | D、④-b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com