
某学生欲完成2HCl+2Ag═2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是()
A. 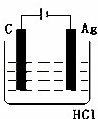 B.
B. 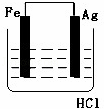 C.
C. 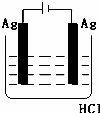 D.
D. 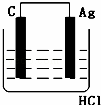
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: 盐酸和银不能自发的进行氧化还原反应,所以不能设计成原电池,只能设计成电解池,失电子的物质作电解池阳极,金属或导电的非金属作电解池阴极,失电子的物质作电解质溶液.
解答: 解:2HCl+2Ag=2AgCl↓+H2↑不能自发进行,所以必须设计成电解池,该反应中银失电子,所以银作电解池阳极,金属或导电的非金属作电解池阴极,该反应中氯化氢得电子生成氢气,则选取盐酸作电解质溶液,所以C选项符合条件,
故选C.
点评: 本题考查原电池和电解池原理,明确原电池形成条件是解本题的关键,注意原电池必须是自发的进行氧化还原反应,为易错点.


科目:高中化学 来源: 题型:
(1)等物质的量的钠、镁、铝与足量盐酸反应,在相同条件下产生氢气的体积之比是 : .
(2)等质量的钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积之比 :: .
查看答案和解析>>
科目:高中化学 来源: 题型:
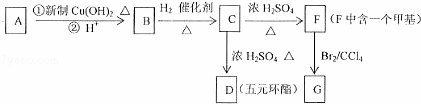
某有机物A的分子式为C5H8O2,A中碳链无支链,1mol A能与2mol H2发生加成反应,但不能与溴水发生加成反应,根据下面转化关系回答下列问题:
(1)C的分子式为 ;
(2)A的结构简式为 ,D的核磁共振氢谱图中将出现 种峰;
(3)G中所含官能团的名称为 ;
(4)B→C的反应类型是 ,C→D的反应类型 ;(选择填空)
a.消去反应 b.加成反应 c.还原反应 d.酯化反应
(5)写出G与NaOH溶液反应的化学方程式: ;
(6)M是F的同系物,其相对分子质量比F小14,写出满足条件的M的所有可能的结构(不包括顺反异构) .
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,对于反应:2SO2(g)+O2(g)⇌2SO3(g),SO2和O2起始时分别为20mol和10mol;达平衡时,SO2的转化率为80%.若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为()
A. 10 mol和10% B. 20 mol和20% C. 20 mol和40% D. 20 mol和80%
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,反应H2(g)+I2(g)⇌2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是()
A. 容器体积不变,升温正反应速率减小
B. 温度、压强均不变,充入HI气体,开始时正反应速率增大
C. 温度不变,压缩气体的体积,平衡不移动,颜色加深
D. 容器体积、温度不变,充入氦气后,正反应速率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
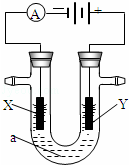
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为 ;在X极附近观察到的现象是 .
②Y电极上的电极反应式为 ;检验该电极反应产物的方法是 .
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是纯铜,电极反应式为 .
②Y电极的材料是粗铜,电极反应式为 (说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列仪器:①容量瓶,②蒸馏烧瓶,③漏斗,④燃烧匙,⑤天平,⑥分液漏斗,⑦胶头滴管,常用于混合物质分离的是()
A. ①③⑤ B. ②④⑦ C. ①②⑥ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下有①6.72L CH4 ②3.01×1023个 HCl分子③13.6g H2S,下列对这三种气体的关系从小到大的排列顺序是:(填写序号)
A、物质的量①③② B、体积①③② C、质量①③② D、氢原子数②③①.
查看答案和解析>>
科目:高中化学 来源: 题型:
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是()
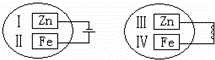
A. Ⅰ和Ⅲ附近 B. Ⅰ和Ⅳ附近 C. Ⅱ和Ⅲ附近 D. Ⅱ和Ⅳ附近
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com