
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应.请回答下列问题:
(1)写出B、C、E元素的名称B___________、C__________、E_____________。
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为____________。
(3)不能验证C和F两种元素非金属性强弱的结论是(填编号)________。
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为________、________,这两种酸式盐相互反应的离子方程式为_______。
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为___________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________。
①a mol ②b mol ③ a/3mol ④ b/3mol ⑤0 ⑥(4a﹣b)mol
【答案】氮 氧 铝 ![]() ① NaHSO3 NaHSO4
① NaHSO3 NaHSO4 ![]()
![]() ②
②
【解析】
A、B、C、D、E、F是短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,则A为H元素;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X,则B为N元素,X为NH4NO3;D与A同主族,且D的原子序数大于N元素,故D为Na元素;F元素的最外层电子数是其次外层电子数的![]() 倍,F原子有3个电子层,最外层电子数为6,故F为S元素;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为O元素;D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,是氢氧化铝与强碱、强酸反应,可推知E为Al元素,据此分析解答。
倍,F原子有3个电子层,最外层电子数为6,故F为S元素;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为O元素;D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,是氢氧化铝与强碱、强酸反应,可推知E为Al元素,据此分析解答。
根据上述分析,A为H元素,B为N元素,C为O元素,D为Na元素,E为Al元素,F为S元素。
(1)由上述分析可知,B、C、E元素的名称分别为:氮、氧、铝;
故答案为:氮;氧;铝;
(2) C、D两种元素形成的原子个数比为1:1的物质为Na2O2,其电子式为;![]() ;
;
故答案为:![]() ;
;
(3) ①单质的熔点属于物理性质,与元素的非金属性无关,不能根据熔点比较元素的非金属性,①不能验证;
②元素的单质与氢气化合越容易,元素的非金属越强,②能验证;
③氢化物的还原性越强,元素的非金属性越弱,③能验证;
故答案为:①;
(4) H、O、N、S四种元素可以形成两种可以互相反应的酸式盐(均由四种元素组成)分别为NaHSO3、NaHSO4;这两种酸式盐相互反应的离子方程式为![]() ;故答案为NaHSO3;NaHSO4;
;故答案为NaHSO3;NaHSO4;
(5)H、O、S间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,则甲与乙反应的离子方程式为:![]() ,
,
故答案为![]() ;
;
(6)向含有a mol AlCl3的溶液中加入含b mol NaOH的溶液,可能发生的反应有①![]() ,②
,②![]() 。
。
当a∶b≥1∶3时,只发生反应①,二者恰好反应时得到沉淀为amol或![]() mol,氯化铝过量时,得到沉淀小于amol,可能为
mol,氯化铝过量时,得到沉淀小于amol,可能为![]() mol;
mol;
当a∶b≤1∶4时,只发生反应②,没有沉淀生成,即沉淀为0;
当1∶3<a∶b<1∶4时,发生反应①②,则:
AlCl3 + 3NaOH = Al(OH)3↓+3NaCl
xmol 3xmol xmol
AlCl + 4NaOH = NaAlO2+3NaCl
(a-x)mol 4(a-x)mol
则3xmol+4(a-x)mol=b,解得x=(4a-b),即沉淀为(4a-b)mol,由于部分铝离子转化为氢氧化铝沉淀,可能为![]() mol;
mol;
由氢氧根守恒可知,氢氧化铝的物质的量不可能等于NaOH物质的量,即沉淀不能为bmol,
综上分析可知,沉淀可能为①a mol、③![]() mol、④
mol、④![]() mol、⑤0、⑥(4a-b)mol,不可能为②b mol,故答案为②。
mol、⑤0、⑥(4a-b)mol,不可能为②b mol,故答案为②。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】一种用离子液体作电解液的混合动力电池放电原理图如图所示,已知充放电时的电池反应为4LiA12C17+3LiFePO4(s)![]() A1+3FePO4+7LiA1C14。下列说法正确的是
A1+3FePO4+7LiA1C14。下列说法正确的是

A.放电时,向正极迁移的是 Al3+
B.放电时,A1极上的电势比FePO4极上的高
C.充电时,阴极反应式:A12C17-+6e- = 2A1+7C1-
D.充电时,阳极反应式:LiFePO4—e- = FePO4+Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B. 2molH2O2(l)的能量高于2molH2O(l)的能量
C. 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D. 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
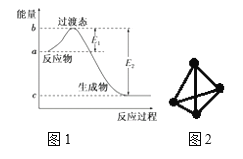
(1)图1是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l)+ 1/2O2(g)═CO2(g)+2H2(g)△H= -a kJ·mol-1 ,则a________726.5(填“>”、“<”或“=”)。
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图2所示),与白磷分子相似。已知断裂1mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为2 mol N2时的△H= ________。
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。这两步的能量变化如图:

第二步反应是________反应(填“放热”或“吸热”)。1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
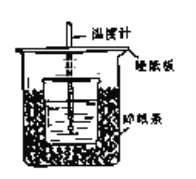
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________;由图可知该装置有不妥之处,应如何改正?___________________________________________________.
(2)烧杯间填满碎塑料泡沫的作用是__________________________________________.
(3)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求得的中和热数值___________(填“相等、不相等”)
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会____________(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
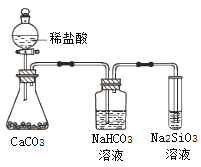
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G各物质间的关系如下图,其中B、D为气态单质。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为__________________________;
若只能在加热情况下进行,则反应物A应为________;
(3)写出D转化为G的化学方程式_____________________________________;
(4)新配制的F溶液应加入________以防止其转化为G。检验G溶液中阳离子的常用试剂是________,实验现象为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的内容:

![]() 该硫酸的物质的量浓度为______
该硫酸的物质的量浓度为______![]() 。
。
![]() 某化学小组进行硫酸酸性实验探究时,需要配制
某化学小组进行硫酸酸性实验探究时,需要配制![]() 的稀硫酸,则需要取上述的浓硫酸______mL。
的稀硫酸,则需要取上述的浓硫酸______mL。
(3)下列情况使所配制硫酸溶液物质的量浓度偏高的是________,
A.未经冷却趁热将溶液注入容量瓶中
B.定容时仰视读数
C.移液时不慎将少量溶液滴在容量瓶外面
D.用量筒量取浓硫酸时仰视读数
E.加蒸馏水时不慎超过了刻度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com