
| A. | $\frac{(n-2m)}{V}mol•{L^{-1}}$ | B. | $\frac{(n-m)}{V}mol•{L^{-1}}$ | C. | $\frac{(2n-2m)}{V}mol•{L^{-1}}$ | D. | $\frac{(2n-4m)}{V}mol•{L^{-1}}$ |
分析 根据SO42-+Ba2+═BaSO4↓计算溶液中的Ba2+离子的物质的量,根据Ag++Cl-=AgCl↓算Cl-的物质的量,再根据c=$\frac{n}{V}$计算Ba2+离子、Cl-离子浓度,利用电荷守恒有2c(Ba2+)+c(K+)=c(Cl-),据此计算原溶液中的K+浓度.
解答 解:BaCl2和NaCl的混合溶液a L,将它均分成两份,
一份滴加稀硫酸,使Ba2+完全沉淀,消耗m molH2SO4,则:
SO42-+Ba2+═BaSO4↓
m mol m mol
c(Ba2+)=$\frac{mmol}{0.5VL}$=$\frac{2m}{V}$cmol/L,
另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗ymolAgNO3,则:
Ag++Cl-=AgCl↓
n mol n mol
c(Cl-)=$\frac{nmol}{0.5VL}$=$\frac{2n}{V}$mol/L,
溶液不显电性,由电荷守恒可知,c(K+)+$\frac{2m}{V}$mol/L×2=$\frac{2n}{V}$mol/L,
解得c(K+)=$\frac{2n-4m}{V}$mol/L,
故选D.
点评 本题考查混合物的有关计算、物质的量浓度的计算等,清楚发生的离子反应及溶液不显电性是解答本题的关键,熟悉物质的量浓度的计算公式,注意两等份溶液的浓度关系.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,产率高,易于实验室制备.其原理如图所示,其总电解反应为:
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,产率高,易于实验室制备.其原理如图所示,其总电解反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 能量变化是化学反应的基本特征之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
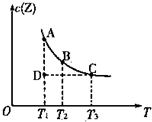 在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )
在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )| A. | A点与B点相比,B点的c(X)大 | B. | A点与C点的化学反应速率:A<C | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | 该反应的正反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ⑤ | C. | ②⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | A | B | C | D |
| n(CO2)(mo1) | 1 | 2 | 3 | 4 |
| n(沉淀)(mo1) | 1 | 1 | 2 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.8L | B. | 14L | C. | 19.6L | D. | 18.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com