
| A、金属腐蚀的本质是金属原子失去电子而被氧化 |
| B、金属腐蚀一般包括化学腐蚀和电化学腐蚀 |
| C、纯的金属一般难以发生电化学腐蚀 |
| D、镀锌铁当镀层破损后,镀层则对铁失去了保护作用 |


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
 在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K和温度的关系如下:
在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K和温度的关系如下:| t℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠(s) |
| B、硫酸钠(s) |
| C、醋酸钠(s) |
| D、硫酸铵(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、改变温度可以改变此反应的平衡常数 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D、反应可表示为X+3Y?2Z,其平衡常数为1600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
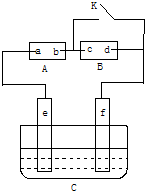 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、移向Zn极,阳离子移向Cu极 |
| B、移向Cu极,阳离子移向Zn极 |
| C、和阳离子都移向Zn极 |
| D、和阳离子都移向Cu极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤⑧⑨ |
| B、①②③⑤⑧⑨ |
| C、①②③⑤⑥⑦⑧ |
| D、①②③⑤⑦⑨⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com