
科目:高中化学 来源: 题型:
SO2是一种重要的化工原料,也是一种环境污染物。
(1)SO2可用于工业制Br2过程中吸收潮湿空气中的Br2,反应的离子方程式是 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸
雨的反应: 。
(3)工业上用Na2SO3溶液吸收烟气中的SO2。
将烟气通入1.0 mol•L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32-)的浓度是0.2 mol•L-1,则溶液中c(HSO3-)是_________mol•L-1,
由此说明NaHSO3溶液显 性,用化学平衡原理解释: 。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数,下列说法正确的是
A.含有NA个氖原子的氖气在标准状况下的体积约为11.2L
B.2.3gNa被O2完全氧化时,失去电子数为0.1NA
C.2Llmol/L的盐酸中所含氯化氢分子数约为2NA
D.标准状况下,5.6LCCl4含有的分子数为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,c(CH3COO-)= c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- )
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末, C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。回答下列问题:
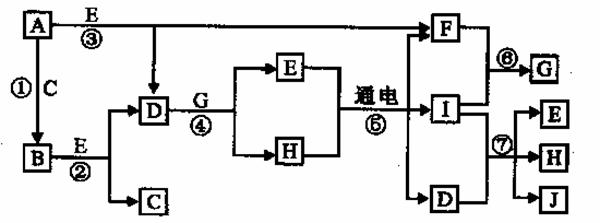
(1)B中阴离子的电子式为 ,与E组成元素相同的化合物的结构式为 。
(2)已知D与G反应生成ImolE放出的热量为aKJ,请写出表示D与H2SO4中和热的热化学方程式 。
(3)向FeCl2溶液中加入大量固体B,写出反应离子方程式 。
(4)常温下以Pt为电极电解滴加有少量酚酞的H饱和溶液2L,则在 (填“阴或阳”)极附近溶液由无色变为红色,若用F、C组成电池(熔融K2CO3做电解质)供电,电池的负极反应式为 ,正极反应式为 ,电解过程中,忽略溶液体积变化,则当溶液的PH=13时,负极消耗气体的体积在标况下为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是:
①H2O ②NH3 ③F- ④CN- ⑤CO
A.①② B.①②③④⑤
C.①②③ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组表述中,两个微粒不属于同种元素原子的是:
A.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p64s2的原子
B.3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2的原子
C.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布为2s22p5的原子
D.最外层电子数是核外电子总数的1/5的原子和最外层电子排布为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
天然存在的金属钫(Fr)极微量。已知其21个同位素都有放射性。它是碱金属元素中最重
的元素。根据它在周期表中的位置预言其性质,其中不正确的是 ( )
A.在已知元素中具有最大的原子半径 B.在空气中燃烧时生成氧化物Fr2O
C.氧化物对应的水化物是极强的碱 D.其单质的熔点比金属钠的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家侯德榜创立了
更为进侯德榜制碱法,也叫联合制碱法,两种制碱的生产流程可简要表示如下图:


氨碱法生产流程 联合制碱法生产流程
(1)向沉淀池中通入CO2和氨气时,应先通入氨气的原因是
(2)沉淀池中发生反应的化学反应方程式是 从沉淀池中分离沉淀的操作是
(3)氨碱法生产流程示意图中的Y是 ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 .
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是 (选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合制碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联合制碱法的另一项优点是
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com