
能正确表示下列反应的离子方程式
A.浓盐酸与铁屑反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
B.钠与CuSO4溶液反应:2Na + Cu2+ = Cu↓+ 2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32- + 2H+ = H2O + CO2↑
D.金属铝溶于氢氧化钠溶液: 2Al+2OH-+2H2O=2[Al(OH)4]-+ 3H2↑
科目:高中化学 来源:2016届河南省高三上学期第八次大考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中,一定能大量共存的是
A.在0.1 mol·L-1NaOH溶液中:K+、Na+、SO42-、HCO3-
B.在0.1 mol·L-1Na2CO3溶液中:A13+、Na+、NO3-、C1-
C.在0.1 mol·L-1FeCl3溶液中:K+、NH4+、I-、SCN-
D.在c(H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:选择题
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO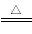 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO
B.NaCl、NaClO3
C.NaClO、NaClO3
D.NaClO3、NaClO4
查看答案和解析>>
科目:高中化学 来源:2015-2016宁夏回族自治银川一中高一上期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
①江河入海口三角洲的形成通常与胶体的性质有关
②“钡餐”中使用的硫酸钡是弱电解质
③冰和干冰既是纯净物又是化合物
④雾是气溶胶,在阳光下可观察到丁达尔现象
⑤某无色溶液中加入稀盐酸,产生的气体可使澄清石灰水变浑浊,则原溶液中一定含CO32-
⑥可用渗析法分离Fe(OH)3胶体和KCl溶液
A.①③④⑤ B.①③④⑥
C.①③④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016届北京市朝阳区高三上学期期中统考化学试卷(解析版) 题型:选择题
处理污水的絮凝剂聚合硫酸铁的化学式是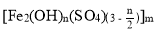 ,下列有关该物质说法不合理的是
,下列有关该物质说法不合理的是
A.铁元素的化合价为+3价
B.n 取值范围是:0<n≤6
C.不能在酸性较强的环境中使用
D.若n=2时,构成该物质的三种微粒个数比为1:1:1
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列离子方程式的书写正确的是
A.Ba(OH)2与H2SO4两稀溶液混合:Ba2++OH- +H++SO42—=BaSO4 ↓+H2O
B.AlCl3溶液中加入过量氨水:Al3++3NH3.HO=Al(OH)3↓ +3NH4+
C.将Na投入到CuSO4溶液:2Na+Cu2+= 2Na++Cu
D.等物质的量的MgCl2、NaOH和HC1溶液混合:Mg2++2OH一=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源:2016届山东省德州市高三上学期期中测试化学试卷(解析版) 题型:实验题
化学是以实验为基础的学科。
(1)下列描述正确的是 (填写序号)。
A.浓硝酸和液溴均保存在棕色试剂瓶中,其目的是防止挥发
B.容量瓶、分液漏斗在使用时需要检验是否漏水
C.海带提碘实验中,灼烧海带时需要用到的仪器有玻璃棒、蒸发皿、泥三角、三脚架、酒精灯
D.向含有Fe2+的FeCl3溶液中通人Cl2或滴加H2O2均可以除去Fe2+
E.检验Na2SO3固体是否被氧化:

(2)某兴趣小组采用如图所示装置制取SO2,并制备硫代硫酸钠(Na2S2O3),反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2;已知硫代硫酸钠受热、遇酸易分解,回答下列问题:
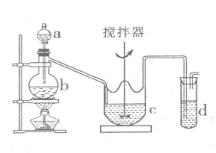
①b中反应的离子方程式为 ,
c中试剂为 。
②反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是 (写物质名称)。
③d中的试剂为 。
④实验中要控制SO2生成速率,可以采取的措施有 (写出两条)。
⑤为了保证硫代硫酸钠的产量,实验中通人的SO2,不能过量,原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届山西省晋中市四校高三上学期期中联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,92 g的NO2和N2 O4混合气体中含有原子数为6 NA
B.惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2 L
C.0.25 mol Na2O2中含有的阴离子数为0.5NA
D.在反应KIO3 +6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期期中模块测试化学试卷(解析版) 题型:实验题
实验室常用的几种气体发生装置如图A、B、C所示:

(1)实验室可以用B或C装置制取氨气,如果用C装置,检查C装置气密性是否良好的操作方法是__________________________。
若用B装置制取氨气,用化学方程式表示制取氨气的反应原理_____________________。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的气体发生装置是_______,用离子方程式表示制取氯气的反应原理________________________。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的______
①CO2 ② NO ③ Cl2 ④ H2 其中在D装置连接小烧杯目的是________________
(4)下图是某同学设计收集氨气的几种装置,其中可行的是_________________。

(5)某兴趣小组同学模拟工业上用离子交换膜法制烧碱的方法,设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为_______________。
②得到的硫酸从 (填A,或D)排放出。
③此时通过阴离子交换膜的离子数 (填大于,小于或等于)通过阳离子交换膜的离子数。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com