
| A. | 0.1 mol•L-1 NaOH溶液中Na+的数目为0.1 NA | |
| B. | 标准状况下,2.24 L CCl4中的分子数目为0.1 NA | |
| C. | 0.1 mol Na2O2与足量CO2反应转移的电子数目为0.1 NA | |
| D. | 3.2 g O2和O3的混合物含有的分子数目为0.1 NA |
分析 A.溶液体积未知;
B.气体摩尔体积使用对象为气体;
C.过氧化钠与二氧化碳反应为歧化反应,消耗1mol过氧化钠转移1mol电子;
D.氧气和臭氧相对分子质量不同.
解答 解:A.溶液体积未知,无法计算钠离子数目,故A错误;
B.标况下四氯化碳为液态,不能使用气体摩尔体积,故B错误;
C.过氧化钠与二氧化碳反应为歧化反应,消耗1mol过氧化钠转移1mol电子,则0.1 mol Na2O2与足量CO2反应转移的电子数目为0.1 NA,故C正确;
D.氧气和臭氧相对分子质量不同,所以只知道混合物质量,无法计算混合物含有的分子数目,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积使用条件和对象,注意过氧化钠与二氧化碳反应化合价变化,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物都能溶于水,而共价化合物都不溶于水 | |
| B. | 离子化合物的熔点一般较高,而共价化合物的熔点一般较低 | |
| C. | 离子化合物的硬度一般较大,而共价化合物的硬度一般较小 | |
| D. | 离子化合物在熔融条件下能够导电,而共价化合物在熔融条件下不能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
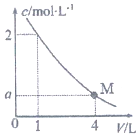 如图是BaC12溶液在稀释过程中,c(Ba2+)随溶液体积的变化曲线图,则M点时,溶液中c(Cl-)为( )
如图是BaC12溶液在稀释过程中,c(Ba2+)随溶液体积的变化曲线图,则M点时,溶液中c(Cl-)为( )| A. | 0.25mol/L | B. | 0.5mol/L | C. | 1 mol/L | D. | 2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
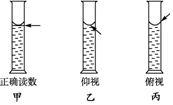 在配制一定物质的量浓度溶液的实验中,用量筒去取用一定量的浓溶液.量液时,量筒必须放平,视线要跟量筒内液体的凹液面最低点保持水平(如图甲),再读出液体的体积数.
在配制一定物质的量浓度溶液的实验中,用量筒去取用一定量的浓溶液.量液时,量筒必须放平,视线要跟量筒内液体的凹液面最低点保持水平(如图甲),再读出液体的体积数.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{1}^{2}$H原子中的中子数和质子数 | |
| B. | ${\;}_{18}^{36}$Ar原子中的质量数与中子数 | |
| C. | ${\;}_{4}^{8}$Be2+中的质子数和电子数 | |
| D. | ${\;}_{12}^{26}$Mg2+中的中子数和电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com