
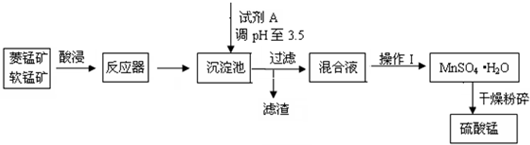
分析 软锰矿(MnO2)菱锰矿(MnCO3)中常混有硫酸亚铁和硫酸镁,酸浸生成亚铁离子、镁离子、锰离子,二氧化锰具有强氧化性,应将Fe2+氧化为Fe3+,浸后加入试剂A,可起到调节pH的作用,使铁离子水解生成沉淀而除去,将滤液蒸发、结晶得到硫酸锰,分离硫酸锰和硫酸镁,应注意二者溶解度的差异,
(1)为增大接触面积,加快反应速率,酸浸前将原材料粉碎;制备硫酸锰,故价硫酸酸浸;试剂A,可起到调节pH的作用,使铁离子水解生成沉淀,为不引入新杂质,加入MnCO3或MnO或Mn(OH)2;
(2)反应器中发生反应有MnCO3溶于酸生成锰离子;
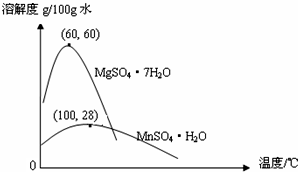
(3)①由图可知60℃时,硫酸镁的溶解度最大;趁热过滤可减少产品的损失;
②饱和硫酸锰溶液能够减少产品一水合硫酸锰的损失;
(4)MnSO4•H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,根据质量守恒可写.
解答 解:(1)为增大接触面积,加快反应速率,酸浸前将原材料粉碎;制备硫酸锰,故价硫酸酸浸;试剂A,可起到调节pH的作用,使铁离子水解生成沉淀,为不引入新杂质,从经济效益考虑,加入MnCO3或MnO或Mn(OH)2;
故答案为:增大接触面积,加快反应速率;H2SO4;MnCO3或MnO或Mn(OH)2;
(2)反应器中发生的离子方程式为:MnCO3+2H+=Mn2++H2O+CO2↑;
故答案为:MnCO3+2H+=Mn2++H2O+CO2↑;
(3)①由图可知60℃时,硫酸镁的溶解度最大,便于硫酸锰与硫酸镁的分离;为防止硫酸镁的结晶析出,提高硫酸锰的产率,趁热过滤;
故答案为:防止MgSO4结晶析出,提高MnSO4的产率;
②蒸馏水、稀硫酸、氢氧化钠洗涤晶体,会损失一水合硫酸锰,饱和硫酸锰溶液能够减少产品一水合硫酸锰的损失;
故答案为:C;
(4)MnSO4•H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,化学方程式为:3MnSO4•H2O $\frac{\underline{\;1150℃\;}}{\;}$Mn3O4+SO2↑+2SO3↑+3H2O↑;
故答案为:3MnSO4•H2O $\frac{\underline{\;1150℃\;}}{\;}$Mn3O4+SO2↑+2SO3↑+3H2O↑.
点评 本题考查混合物的分离和提纯,为高频考点,侧重考查分析实验能力,明确流程图中发生的反应及操作方法是解本题关键,注意把握物质的性质异同以及题给信息,题目难度不大.


科目:高中化学 来源: 题型:解答题
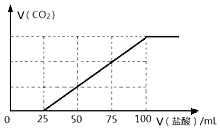 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
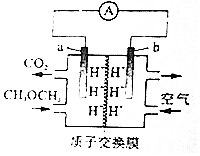
| A. | a极区域溶液的pH变大 | |
| B. | b极有H2O生成 | |
| C. | a极反应式:CH3OCH3+3O2--12e-═2CO2↑+6H+ | |
| D. | 每消耗11.2LO2(标准状况).有2molH+向左侧移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M可能是甲醛,也可能是乙醛 | |
| B. | 混合物中必有乙醛,其物质的量为0.06mol | |
| C. | 不能判断出N是何种醛,但其物质的量是0.06mol | |
| D. | M一定是甲醛,N一定是丙醛,其物质的量之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.5 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.4 mol/(L•s) | B. | v(B)=0.8 mol/(L•s) | C. | v(C)=1.2 mol/(L•s) | D. | v(D)=0.7 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铝、铜、铁片插入浓硫酸,以证明常温下Al、Fe、Cu能否与浓硫酸反应 | |
| B. | 加过量NaOH溶液,过滤弃去沉淀,以除去混在Al2O3中的Fe2O3 | |
| C. | 将铁器、铜器放入盐酸中浸泡,以除去表面的铁锈和铜绿[Cu2(OH)2CO3] | |
| D. | 将FeCl3、CuCl2溶液在蒸发皿中加热蒸干,以制得FeCl3、CuCl2固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com