
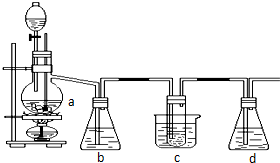
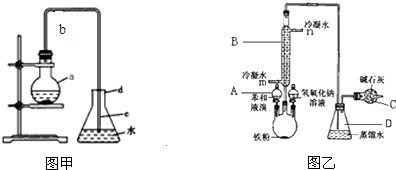
 1、2-二溴乙烷可作汽油抗爆剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4 0C,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室可以用下图所示装置制备1、2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管c中装有浓溴水.
1、2-二溴乙烷可作汽油抗爆剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4 0C,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室可以用下图所示装置制备1、2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管c中装有浓溴水.分析 (1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷;
(2)乙醇和浓硫酸加热到1400C时会生成乙醚;
(3)根据乙醇和浓硫酸加热会发生副反应及乙烯与溴反应的利用率减少的可能原因进行解答;
(4)C中的氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应;反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用e吸收
解答 解:(1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷,发生反应的化学方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br2→CH2BrCH2Br;
(2)乙醇和浓硫酸加热到1400C时会生成乙醚,反应的方程式为CH3CH2OH+C2H5OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O,
故答案为:CH3CH2OH+C2H5OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O;
(3)乙醇和浓硫酸加热制乙烯时,产生乙烯的速率太快,许多乙烯气体没有与溴反应就溢出,以及没有迅速加热到170℃,使很多乙醇没有反应生成乙烯而是生成乙醚,另外大量乙醇被浓硫酸碳化,后与浓硫酸反应生成CO2和SO2和大量乙醇挥发等都会导致所消耗的乙醇和浓硫酸混合液的量比理论值超出许多,
故答案为:产生乙烯的速率太快,许多乙烯气体没有与溴反应就溢出;没有迅速加热到170℃,使很多乙醇没有反应生成乙烯而是生成乙醚等;
(4)装置C中盛有氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应;该反应中生成的溴化氢及反应物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收HBr和Br2等气体,防止大气污染,
故答案为:吸收乙烯气体中含有的CO2、SO2等酸性气体;吸收HBr和Br2等气体,防止大气污染.
点评 本题考查了溴乙烷的制取,题目难度中等,注意掌握溴乙烷的制取原理,明确装置中氢氧化钠溶液的作用,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3 $\stackrel{高温}{→}$CaO $\stackrel{{H}_{2}O}{→}$Ca(OH)2$→_{过滤}^{N{a}_{2}C{O}_{3}溶液}$ NaOH溶液 | |
| B. | Cu$→_{△}^{O_{2}}$CuO$→_{△}^{H_{2}SO_{4}}$CuSO4溶液$→_{过滤}^{NaOH溶液}$Cu(OH)2沉淀 | |
| C. | KMnO4$\stackrel{△}{→}$O2$\stackrel{s}{→}$SO2$\stackrel{{H}_{2}O}{→}$H2SO3 | |
| D. | BaCO3$\stackrel{盐酸}{→}$BaCl2溶液$\stackrel{NaOH溶液}{→}$Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6~10的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应至6min时,c(H2O2)=0.20mol/L | |
| D. | 反应至6min时,H2O2分解了40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com