
科目:高中化学 来源: 题型:解答题
| 组别 | 草酸的体积(mL) | 温度 | 其他物质 |
| ① | 2Ml | 20 | 无 |
| ② | 2mL | 20 | 10滴饱和MnS04溶液 |
| ③ | 2mL | 30 | 无 |
| ④ | 1mL | 20 | 1mL蒸馈水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
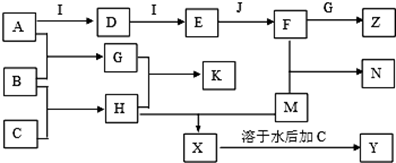
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
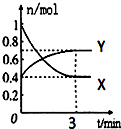 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)?N2O4(g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中正确的是( )
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③140℃}^{浓硫酸}$D,下列相关说法中正确的是( )| A. | 烃A为CH3CH3 | B. | 反应②属于消去反应 | ||
| C. | 反应①②③都属于取代反应 | D. | 化合物D属于醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 g | B. | 5.6g | C. | 8.4g | D. | 2.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com