
| A. | 气态氢化物的稳定性:H2O>H2S>SiH4 | |
| B. | 离子半径:Cl->O2->Mg2+ | |
| C. | 物质酸性:H3PO4>H2SO4>HClO4 | |
| D. | 熔点:KCl>K |
分析 A.元素的非金属越强,其氢化物的稳定性越强;
B.电子层数越多,离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.离子晶体熔沸点较高,K为金属单质,熔沸点较低.
解答 解:A.元素的非金属越强,其氢化物的稳定性越强,非金属性O>S>Si,所以氢化物的稳定性H2O>H2S>SiH4,故A正确;
B.电子层数越多,离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,氯离子有3个电子层,离子半径最大,氧离子和镁离子电子层结构相同,且Mg原子序数大于O,所以离子半径大小顺序是Cl->O2->Mg2+,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>Si,所以物质酸性:H3PO4<H2SO4<HClO4,故C错误;
D.离子晶体熔沸点较高,K为金属单质,熔沸点较低,KCl是离子晶体,熔沸点高于K,故D正确;
故选C.
点评 本题考查元素周期律,为高频考点,侧重考查学生分析判断及知识运用能力,明确同一周期、同一主族元素原子结构和元素性质递变规律是解本题关键,注意基础知识的总结归纳和运用,题目难度不大.


科目:高中化学 来源: 题型:实验题
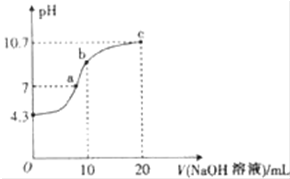 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤ | C. | ②③④ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷、乙烯 | B. | 乙烯、乙炔 | C. | 氯乙烯、溴乙烯 | D. | 苯、2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
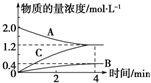 如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:
如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②②③ | B. | ②③②① | C. | ②①②③ | D. | ①①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com