
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3 ;
;
查看答案和解析>>
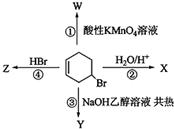
科目:高中化学 来源: 题型:解答题
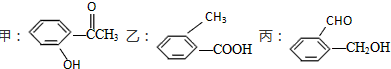
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
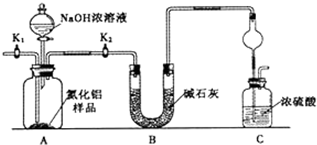
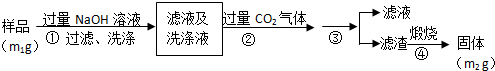
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
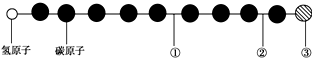
| A. | ①处的化学键是碳碳双键 | B. | ②处的化学键是碳碳三键 | ||
| C. | ③处的原子可能是氯原子或氟原子 | D. | ②处的化学键是碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
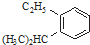 的炔烃的结构简式
的炔烃的结构简式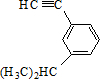 ;
; ;
;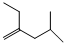 .
.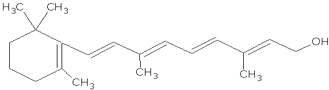 1mol维生素A最多能与5mol溴发生加成反应.
1mol维生素A最多能与5mol溴发生加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com