
����Ŀ��2019��5��23�գ��������ձ�������Ϣ�ƣ���ˮ�ⷢ�������ڵ������ߣ����гƣ�������ˮ����ʵʱ��ȡ����������ֻ���ˮ������ʻ�������·����������㷺���ɡ��ݱ������÷������ĺ���ԭ������������ˮ���з�Ӧ�õ���������Ϊ��������ȼ�ϡ�����������������������������������ˮ����������ԭ�����һ�ޣ��������ۼ���ɵô���������������Һ�����۷�Ӧ�IJ������ʱ�������ˮ�߳�һ��������˵������ȷ����( )
A.����������ˮ�ķ�Ӧ�����Է���Ӧ�������ӹ�Ϊ��ϸ���ۣ������˷�Ӧ�Ӵ������ʹ�÷�Ӧ��Ϊ�Է���Ӧ
B.�Ʋ���Һ�����۷�Ӧ��ˮ��Ŀ���ԭ������Ϊ��Һ�������ԣ��������ᷴӦ���ʼӿ�
C.ˮ��Ϊ������������ȱ���Ƿ�Ӧ���ɵ������������������������������棬�谭��Ӧ����
D.����õ���������Ϊ10L���������������������Ϊ8.0g
���𰸡�A
��������
A������������ˮ�ķ�Ӧ�dz����������ӹ�Ϊ��ϸ���ۣ������˷�Ӧ�Ӵ�������ӿ��˷�Ӧ���ʣ������ܽϿ�ز�������������Ӵ����������ʹ���Է���Ӧ��Ϊ�Է���Ӧ����A����
B�������ᷴӦ���ʴ�������ˮ�ķ�Ӧ���ʣ��Ʋ���Һ�����۷�Ӧ��ˮ��Ŀ���ԭ������Ϊ��Һ�������ԣ���Ӧ���ʼӿ죬��B��ȷ��
C��ˮ������Ӧ������������ͬʱ�����������������������������������棬�谭��Ӧ���У���C��ȷ��
D������õ���������Ϊ10L�����������ݵ����غ㣬��õ����ӵ����ʵ���������ʧȥ���ӵ����ʵ������������������۵���������Ϊ![]() =8.0g����D��ȷ��
=8.0g����D��ȷ��
��ѡA��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��һ�ַḻ����Դ����ҵ�ϿɴӺ�ˮ����ȡ�������ʣ��㷺Ӧ��������������Ƽ��ȷ��档��ͼ��ij�����Ժ�ˮ��Դ�����ۺ����õ�ʾ��ͼ��

�ش��������⣺
��1������ͼ�в���a������Ϊ____��
��2����ҵ�ϴӺ�ˮ����ȡ��NaCl����������ȡ������Ҫ�������£���ʳ��ˮ����ͨ������A����ͨ������B����ַ�Ӧ����˵õ�����C����ҺD��������C���ռ����Ƶô��
������A��B��CO2��NH3��������AӦ��_____(�ѧʽ)
����ҺD����Ҫ����NH4Cl��NaHCO3�����ʣ���ҵ��������ҺD��ͨ��NH3��������ϸСʳ�ο�������ȴ����������NaHCO3�ĸ���ƷNH4Cl���壬��ͨ��NH3��������____��
��3��þ��һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�Ӻ�ˮ����ȡ��
����Ҫ��֤������ˮMgCl2�в���NaCl����IJ���������_____��
�ڲ���b����___��Χ�н��У����ڿ����м��ȣ��������Mg(OH)Cl��д���йط�Ӧ�Ļ�ѧ����ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ�ӡ�Ԫ�ء����ء�ͬλ�صȶ�������Ҫ�Ļ�ѧ����������а��ֻ�ѧ���ţ�![]() H��
H��![]() H��
H��![]() C��
C��![]() Li��
Li��![]() Na��
Na��![]() N��
N��![]() Li��
Li��![]() Mg
Mg
��1���漰�ĺ��ع���__�֣�
��2����Ϊͬλ�ص���__��__��
��3����������ȣ������ܻ���Ϊͬλ�ص���__��
��4����������ȣ�������������ȵ���__��
��5���������ͬλ����__���������ȵ�ͬλ��35Cl��37Cl����Ϊ�Ȼ��⣬�ɵ��Ȼ�����ӵ�����Ϊ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�������
A.����ϵͳ�������������� ������Ϊ2��3��������3���һ�����
������Ϊ2��3��������3���һ�����
B.�����ס����ȵ����ʿ�����ˮ������Щ��������Һ�м��루NH4��2SO4��Na2SO4��Ũ��Һ����ʹ�����ʵ��ܽ�Ƚ��Ͷ�����
C.![]() �ɷ����ӳɷ�Ӧ��ȡ����Ӧ��������Ӧ
�ɷ����ӳɷ�Ӧ��ȡ����Ӧ��������Ӧ
D.�л���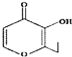 ���׳���һ����������һ�ֺ�������ͬ���칹���ܷ���������Ӧ
���׳���һ����������һ�ֺ�������ͬ���칹���ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ����
A.���³�ѹ�£�14 g N2���з�����ΪNA
B.����������ˮ��Ӧ������0.1 mol����ʱ��ת�Ƶĵ�����Ϊ0.2NA
C.���ʵ���Ũ��Ϊ0.5 mol/L��MgCl2��Һ������Cl-��ĿΪ1NA
D.һ�������£�0.01 mol FeCl3��ˮ��ȫ��Ӧ�Ƴɽ��壬�京�е�Fe(OH)3������Ϊ0.01 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ��е�һ���֡�
�� ���ڡ��� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | A | |||||||
2 | E | F | H | J | ||||
3 | B | C | D | G | I |
����A��J�����ڱ��е�λ�ã���Ԫ�ط��Ż�ѧʽ�ش��������⣺
(1)��ѧ��������õ�Ԫ����________����������ǿ�ĵ�����________����ԭ����ǿ�ĵ�����________��
(2)����������Ӧ��ˮ�����У�������ǿ����________��������ǿ����________�������Ե���________��
(3)A�ֱ���E��F��G��H��I�γɵļ���̬�������У����ȶ�����________��
(4)��B��C��D��G��I�У�ԭ�Ӱ뾶������________��
(5)Ԫ��C��I�γɵĻ�����ĵ���ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һƿ��ɫ�������Һ�����п��ܺ���H+��![]() ��Na+��Al3+��Fe3+��I-��
��Na+��Al3+��Fe3+��I-��![]() ��
��![]() ��
��![]() ��
��![]() ��ȡ����Һ��������ʵ�飺
��ȡ����Һ��������ʵ�飺
����pH��ֽ���飬��Һ��ǿ���� ��ȡ��Һ��������������CCl4������������ˮ����CCl4����Ϻ�ɫ �۸���Һ����ɫ��Ӧû�л�ɫ����������ʵ�����������ƶ���ȷ����( )
A.�����Һ�м���BaCl2��һ���ܹ۲쵽��ɫ����
B.����ȷ��û��Na+��Fe3+��![]() ��
��![]() ������ȷ���Ƿ���
������ȷ���Ƿ���![]()
C.����Һ������NH4NO3��HI�Ļ��
D.һ��û��Al3+��![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����������з�һС���ƣ��������ۻ�ʱ���ò�����պȡ������ˮCuSO4���ۻ����ƽӴ���˲�����ҫ�۵Ļ�ͬʱ�к�ɫ�������ɣ��ݴ��жϣ�����˵����ȷ����

A.������Ӧ����˵���Ʊ�ͭ����
B.������Ӧ������ֻ��һ��������ԭ��Ӧ����
C.��������ˮ�����£�Na������CuSO4��Ӧ������Cu
D.����������Ӧ��˵���ƿ��Դ�����ͭ����Һ���û���ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���1.0mol CO��1.0mol H2O��ϼ��ȵ�800�棬�������з�Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol��������˵����ȷ���ǣ� ��
CO2��g��+H2��g����һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol��������˵����ȷ���ǣ� ��
A.800���£��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ0.25
B.427��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ9.4����÷�Ӧ�ġ�H��0
C.800���£����������ƽ����ϵ��ͨ��1.0mol��CO��g������ƽ��ʱCO���ʵ�������Ϊ33.3%
D.800���£����������ƽ����ϵ��ͨ��1.0mol��H2O��g������ƽ��ʱCOת����Ϊ33.3%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com