
 NH3↑+H2O (1分);
NH3↑+H2O (1分); NH3↑+H2O。
NH3↑+H2O。

科目:高中化学 来源:不详 题型:单选题
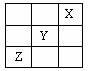
| A.X是活泼的非金属 |
| B.三种元素中Y的非金属性最强 |
| C.Z的最高价氧化物的水化物是强酸 |
| D.Y的最高价氧化物的水化物是一种强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤ | B.②④⑥ | C.①②③ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
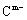 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题: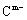 、
、 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.玻尔 | B.卢瑟福 | C.汤姆生 | D.道尔顿 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com