
科学家一直致力于“人工固氨”的新方法研究。目前合成氨技术原理为:N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。

(1)下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0 L恒容得密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下,N2(g)+3H2(g)  2NH3(g)的平衡常数值为:___。
2NH3(g)的平衡常数值为:___。
(3)K值越大,表明反应达到平衡时( )。
A. H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨。其实验装置如图。阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:_____________。

(本题共8分)(1)AC(2分)(2)K=16/15(或1.07或1.1)(2分)
(3)C(2分) (4)N2+6H+ +6e→2NH3(2分)
【解析】
试题分析:(1)A、a点反应物的浓度大于b点,浓度越大反应速率越快,故a点反应速率更大,A正确;B、点c之后氢气的物质的量继续减小,可逆反应未达到平衡状态,反应向正反应方向进行,故B错误;C、d、e对应氢气、氨气的物质的量不变,可逆反应处于平衡状态,点d和点e处的n(N2)相同,故C正确;D、该反应正反应是放热反应,温度升高平衡向逆反应方向移动,氨气的物质的量减小,故D错误,答案选AC。
(2)令平衡时转化的氮气的物质的量浓度为x,则:
N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
起始浓度(mol/L) 0.4 0.8 0
转化浓度mol/L) x 3x 2x
平衡浓度mol/L) 0.4-x 0.8-3x 2x
所以 =20%
=20%
解得x=0.1
因此该温度下平衡常数K= =
=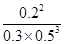 =1.07
=1.07
(3)A、氢气的转化率与氮气、氢气的投入量等有关,K值大,氢气转化率不一定高,故A错误;B、氨气的产率与与氮气、氢气的投入量等有关,K值大,氨气的产量不一定大,故B错误;C、K值越大,表示反应正向进行的程度大,即正反应进行得越完全,故C正确;D、K值越大,表示反应正向进行的程度大,但该温度下不一定反应发生,反应速率不一定大,故D错误,答案选C。
(4)电解池的阴极发生得电子的还原反应,在合成氨反应中,氮气得电子,所以阴极电极反应为N2+6H+ +6e-→2NH3。
考点:考查外界条件对反应速率、平衡状态的影响;平衡常数的计算以及应用;图像识别以及电极反应式的书写等


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源:广东省高考真题 题型:填空题


 。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算
。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算  的平衡常数。
的平衡常数。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com